-
含有11.2 g KOH的稀溶液与1 L 0.1 mol/L的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的化学方程式为( )
A.KOH(aq)+H2SO4(aq)===K2SO4(aq)+H2O(l) Δ H=-11.46 kJ/mol
B.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-11.46 kJ/mol
C.2KOH(aq)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
D.KOH(aq)+ H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol
-
(1)含有11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应,放出11.46 kJ的热量,表示该反应中和热的热化学方程式为___________________________,
表示该反应中和热的离子方程式为_________________________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g) ===2CO2(g)+4H2O(g) ΔH=-1275.6 kJ·mol-1
②H2O(l)===H2O(g) ΔH=+44.0 kJ·mol-1
写出表示甲醇燃烧热的热化学方程式__________________________________。
(3)FeSO4可转化为FeCO3,FeCO3在空气中加热反应可制得铁系氧化物材料。
已知25 ℃,101 kPa时:
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH=-1 648 kJ/mol
C(s)+O2(g)===CO2(g) ΔH=-393 kJ/mol
2Fe(s)+2C(s)+3O2(g)===2FeCO3(s) ΔH=-1 480 kJ/mol
FeCO3在空气中加热反应生成Fe2O3的热化学方程式是
_________________________________________________________________。
(4)在25 ℃、101 kPa下,一定质量的无水乙醇完全燃烧时放出热量Q kJ,其燃烧生成的CO2用过量饱和石灰水吸收可得100 g CaCO3沉淀,则乙醇燃烧的热化学方程式为______________________________________________。
(5)已知反应2HI(g)===H2(g)+I2(g)的ΔH=+11 kJ·mol-1,1 mol H2(g)、1 mol I2(g)分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为________________kJ。
(6)由N2O和NO反应生成N2和NO2的能量变化如图所示,若生成1 mol N2,其ΔH=________kJ·mol-1。

-
含有11.2 g KOH的稀溶液与1 L 0.1 mol•L﹣1的H2SO4溶液反应,放出11.46 kJ的热量,下列热化学方程式正确的是
A. KOH(aq)+ H2SO4(aq) ===
H2SO4(aq) ===  K2SO4(aq)+H2O(l) ΔH =-11.46 kJ•mol﹣1
K2SO4(aq)+H2O(l) ΔH =-11.46 kJ•mol﹣1
B. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =-11.46 kJ•mol﹣1
C. 2KOH(aq)+H2SO4(aq) === K2SO4(aq)+2H2O(l) ΔH =+114.6 kJ•mol﹣1
D. KOH(aq)+ H2SO4(aq) ===
H2SO4(aq) ===  K2SO4(aq)+H2O(l) ΔH =-57.3 kJ•mol﹣1
K2SO4(aq)+H2O(l) ΔH =-57.3 kJ•mol﹣1
-
含11.2g KOH的稀溶液与1L、0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是( )
A、KOH(aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-11.46kJ/mol
B、2KOH(s) + H2SO4(aq) = K2SO4(aq) + 2H2O(l);ΔH =-114.6kJ/mol
C、2KOH(aq) + H2SO4 =K2SO4(aq) + H2O(l);ΔH =+114.6kJ/mol
D、KOH (aq) + 1/2 H2SO4(aq) = 1/2K2SO4(aq) + H2O(l);ΔH =-57.3kJ/mol
-
含11.2g KOH的稀溶液与1L、0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列能正确表示中和热的热化学方程式是( )
A.KOH(aq)+1/2 H2SO4(aq)=1/2K2SO4(aq)+H2O(l);△H=-11.46kJ/mol
B.2KOH(s)+H2SO4(aq)=K2SO4(aq)+2H2O(l);△H=-114.6kJ/mol
C.2KOH(aq)+H2SO4=K2SO4(aq)+H2O(l);△H=+114.6kJ/mol
D.KOH (aq)+1/2 H2SO4(aq)=1/2K2SO4(aq)+H2O(l);△H=-57.3kJ/mol
-
含11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应放出11.46 kJ的热量,下列能正确表示中和热的热化学方程式是( )
A. KOH(aq)+0.5H2SO4(aq)===0.5 K2SO4(aq)+H2O(l) ΔH=-11.46 kJ·mol-1
B. 2KOH(s)+H2SO4(aq)===K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ·mol-1
C. 2KOH(aq)+H2SO4===K2SO4(aq)+H2O(l) ΔH=114.6 kJ·mol-1
D. KOH(aq)+0.5H2SO4(aq)===0.5 K2SO4(aq)+H2O(l) ΔH=-57.3 kJ·mol-1
-
11.2 g KOH的稀溶液与1 L 0.1 mol·L-1的H2SO4溶液反应放出11.46 kJ的热量,该反应的热化学方程式为 ,则KOH与H2SO4的中和热为 。
-
反应2C+O2=2CO 的能量变化如图所示.含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是( )

A.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ
B.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
C.该反应的热化学方程式是2C(s)+O2(g)=2CO(g)△H=-110.5 kJ/mol
D.表示中和热的热化学方程式2KOH (aq)+H2SO4 (aq)=K2SO4(aq)+2H2O (l)△H=-114.6 kJ/mol
-
反应2C + O2=2CO 的能量变化如右图所示。含11.2g KOH的稀溶液与1L0.1mol/L的H2SO4溶液反应放出11.46kJ的热量,下列说法正确的是
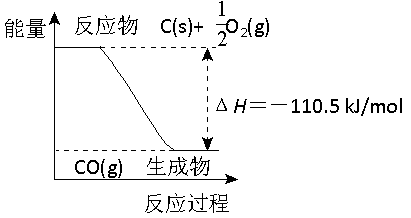
A.2 mol C(s)与足量O2(g)反应生成CO2(g),放出的热量大于221 kJ 1
B.12 g C(s)与一定量O2(g)反应生成14 g CO(g),放出的热量为110.5 kJ
C.该反应的热化学方程式是:2C(s) + O2(g)=2CO(g) ΔH=-110.5 kJ/mol
D.表示中和热的热化学方程式2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) ΔH=-114.6 kJ/mol
-
含有1.2gKOH的稀溶液与1L0.1mol/L的H2SO4溶液反应,放出11.46kJ的热量,表示该反应中和热的化学方程式为( )
A. KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l) △H=-11.46kJ·mol-1
B. 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=-11.46kJ·mol-
C. 2KOH(aq)+H2SO4(aq)=K2SO4(aq)+2H2O(l) △H=+11.46kJ·mol-1
D. KOH(aq)+1/2H2SO4(aq)=1/2K2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
H2SO4(aq)===K2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol


