-
下列化合物中属于弱电解质的是
A.BaSO4 B.HCl C.CO2 D.H2O
难度: 简单查看答案及解析
-
下列水溶液一定呈碱性的是
A.pH=8的溶液 B.含有OH-离子的溶液
C.NaCl溶液 D.c(OH-)>c(H+)的溶液
难度: 中等查看答案及解析
-
25℃时,把下列物质加入水中能促进水电离的是
A.NaCl B.HCI C.NH4Cl D.KOH
难度: 简单查看答案及解析
-
下列事实可证明氨水中的(NH3•H2O)是弱碱的是
A.氨水能被弱酸醋酸中和 B.铵盐受热易分解
C.氨水可以使酚酞试液变红 D.常温下,0.1 mol/L氯化铵溶液的pH约为5
难度: 中等查看答案及解析
-
在H2O+CH3COO-
CH3COOH+OH-的平衡中,要使平衡向右移动,应采取的措施是
A.加入NaOH固体 B.加入冰醋酸 C.增大压强 D.升高温度
难度: 中等查看答案及解析
-
下列过程或现象与水解无关的是
A.纯碱溶液能去油污
B.配制氯化铁溶液时加入少量的盐酸
C.加热稀醋酸溶液其pH稍有减小
D.Na HCO3与Al2(SO4)3混合作泡沫灭火剂
难度: 中等查看答案及解析
-
相同温度下等物质的量浓度的下列溶液中,pH值最大的是
A.NH4Cl B.NH4HCO3 C.NH4HSO4 D.(NH4)2SO4
难度: 中等查看答案及解析
-
有关如右图所示原电池(盐桥中装有含琼胶的KCl饱和溶液)的叙述,不正确的是
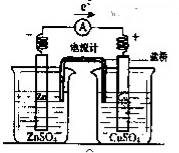
A.铜片上有红色物质附着
B.取出盐桥后,电流计依然发生偏转
C.反应中,盐桥中的K+会移向CuSO4溶液
D.锌片上发生氧化反应
难度: 中等查看答案及解析
-
下列各装置中都盛有0.1 mol·L-1的NaCl溶液,放置相同时间后,锌片的腐蚀速率由快到慢的顺序是
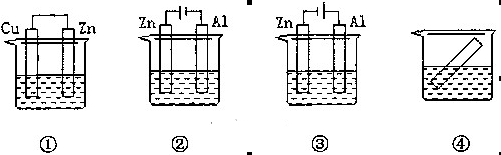
A.③①④② B.①②④③ C.②①④③ D.②①③④
难度: 中等查看答案及解析
-
取100 mL 2mol/L的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是
A.加入适量的6mol/L的盐酸 B.用酒精灯适当加热
C.加入适量蒸馏水 D.加入适量的氯化钠溶液
难度: 中等查看答案及解析
-
用惰性电极实现下列电解实验,其说法正确的是
A.电解稀硫酸溶液,实质上是电解水,故溶液的pH不变
B.电解稀氢氧化钠溶液,阳极消耗OH-,故溶液的pH减小
C.电解硫酸钠溶液,阴极和阳极析出产物的物质的量之比为2:1
D.电解氯化铜溶液,通电一段时间后,向溶液中加入适量的CuO或CuCO3均可使电解液恢复到起始状态
难度: 中等查看答案及解析
-
已知:2Zn(s)+O2(g)=2ZnO(s) △H=-701.0 kJ•mol-1
2Hg(I)+O2(g)=2HgO(s) △H=-181.6 kJ•mol-1
则反应Zn(s)+HgO(s)=ZnO(s)+Hg(I)的△H为
A.-519.4kJ•mol-1 B.+259.7 kJ•mol-1 C.-259.7 kJ•mol-1 D.+519.4 kJ•mol-1
难度: 中等查看答案及解析
-
某原电池总反应为:Cu+2Fe3+=Cu2++2Fe2+下列能实现该反应的原电池是
A B C D
电极材料 Cu、Zn Cu、Ag Cu、C Fe、Zn
电解液 FeCl3 Fe2(SO4)3 Fe(NO3)2 CuSO4
难度: 中等查看答案及解析
-
下列叙述中正确的是
A.常温下,0.01mol·L-1醋酸溶液pH=2
B.95℃纯水的pH<7,说明加热可导致水呈酸性
C.常温下,将pH=3的醋酸溶液稀释至10倍后溶液pH=4
D.常温下,将0.2 mol·L-1的盐酸与等体积水混合后溶液pH=1
难度: 中等查看答案及解析
-
下列实验基本操作正确的是
A.用碱式滴定管量取0.10 mol·L-1的Na2CO3溶液22.10 mL;
B.中和热测定实验中可以用环形铁丝搅拌棒代替环形玻璃搅拌棒
C.经实验测定等物质的量的盐酸、醋酸分别与足量NaOH溶液反应放出的热量相等
D.用玻璃棒蘸取溶液滴到湿润的广范pH试纸上,测其pH=3.6
难度: 中等查看答案及解析
-
室温下向10 mL pH=3的醋酸溶液中加入水稀释后,下列说法正确的是
A.溶液中导电粒子的数目增加,导电性增强
B.醋酸的电离程度增大,c(H+)亦增大
C.再加入10 m L pH=11 NaOH溶液,混合液pH=7
D.溶液中
不变
难度: 中等查看答案及解析
-
汽车的启动电源常用铅蓄电池,放电时的电池反应如下:PbO2(s)+Pb(s)+2H2SO4(aq)=2PbSO4(s)+2H2O(I),根据此反应判断下列叙述中正确的是
A.PbO2是电池的负极
B.负极的电极反应式为:Pb+SO42--2e-=PbSO4↓
C. PbO2得电子,被氧化
D.电池放电时,溶液酸性增强
难度: 中等查看答案及解析
-
对于下图的锌锰电池,下列说法正确的是
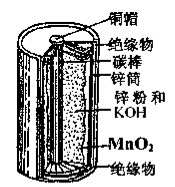
A.MnO2是氧化剂,被氧化
B.碳棒为负极、锌筒为正极
C.放电过程中NH4+向锌极移动
D.负极反应为:Zn-2e-+2OH-=Zn(OH)2
难度: 中等查看答案及解析
-
把Ca(OH)2固体放入一定量的蒸馏水中,一定温度下达到平衡:Ca(OH)2(s)
Ca2+(aq)+2OH-(aq) 当向悬浊液中加少量生石灰后,若温度保持不变,下列判断正确的是
A.溶液中Ca2+数目不变 B.溶液中c(Ca2+)增大
C.溶液pH值不变 D.溶液pH值增大
难度: 中等查看答案及解析
-
把0.02 mol/L CH3COOH溶液和0.01 mol/L NaOH溶液以等体积混和后溶液显酸性,则混合液中微粒浓度关系正确的为
A.c(CH3COO-)<c(Na+)
B.c(CH3COOH)+c(CH3COO-)=0.02 mol/L
C.c(CH3COOH)>c(CH3COO-)
D.c(OH-)+c(CH3COO-)=c(H+)+c(Na+)
难度: 中等查看答案及解析
-
在一体积为10 L的容器中,通入一定量的CO和H2O,在850℃时发生如下反应:
CO(g)+H2O(g)
CO2(g)+H2(g) △H<0。
(1)CO和H2O浓度变化如图,则在该温度下,该反应的平衡常数K= 。
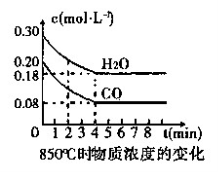
0~4 min的平均反应速率v(CO)= mol·L-1·min-1。若降低温度,该反应的K值将 ,该反应的化学反应速率将 (填“增大”“减小”或“不变”)。
(2)在相同容器中发生上述反应,当温度高于850℃时,容器内各物质的浓度变化如下表。
时间(min)
CO
H2O
CO2
H2
0
0.200
0.300
0
0
2
0.138
0.238
0.062
0.062
3
c1
c2
c3
c3
4
c1
c2
c3
c3
5
0.116
0.216
0.084
6
0.096
0.266
0.104
①表中3 min~4 min之间反应处于 状态;cl数值 0.08 mol·L-1(填大于、小于或等于)。
②反应在4 min~5 min之间,平衡向逆方向移动,可能的原因是
a.增加水蒸气 b.降低温度 c.使用催化剂 d.增加氢气浓度
(3)在相同温度下(850℃),若起始时c(CO)=1mol·L-1,C(H2O)=2mol·L-1,反应进行一段时间后,测得H2的浓度为0.5 mol·L-1,则此时该反应是否达到平衡状态 (填“是”与“否”),此时v(正) v(逆)(填“大于”“小于”或“等于”),你判断的依据是 。
难度: 中等查看答案及解析