-
下列说法正确的是
A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的
B.升高温度或加入催化剂,可以改变化学反应的反应热
C.据能量守恒定律,反应物的总能量一定等于生成物的总能量
D.物质发生化学变化一定伴随着能量变化[
难度: 简单查看答案及解析
-
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是
A.浓硫酸与水 B.熟石灰与水
C.生石灰与水 D.氯化钠与水
难度: 中等查看答案及解析
-
已知2H2(g)+O2 (g)===2H2O(g) ΔH=-483.6 kJ/mol。下列说法或表达正确的是
A.在相同的条件下,2 mol氢气与1 mol氧气的总能量小于2 mol水蒸气的总能量
B.H2(g)+
O2(g)===H2O(l) ΔH=-Q1 kJ/mol 则Q1>241.8
C.H2(g)+
O2(g)===H2O(l) ΔH=-Q2 kJ/mol 则Q2<241.8
D.任何条件下,2 L水蒸气分解成2 L氢气与1 L氧气需吸收483.6 kJ热量
难度: 中等查看答案及解析
-
25 ℃、101 kPa下,碳、氢气、甲烷和葡萄糖的燃烧热依次是393.5 kJ·mol-1、285.8 kJ·mol-1、890.3 kJ·mol-1、2 800 kJ·mol-1,则下列热化学方程式正确的是
A.C(s)+
O2(g)===CO(g) ΔH=-393.5 kJ·mol-1
B.2H2(g)+O2(g)===2H2O(g) ΔH=+571.6 kJ·mol-1
C.CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
D.
C6H12O6(s)+3O2(g)===3CO2(g)+3H2O(l) ΔH=-1 400 kJ·mol-1
难度: 中等查看答案及解析
-
已知下列数据:
2Fe(s)+O2(g)===2FeO(s) ΔH=-544 kJ·mol-1
4Al(s)+3O2(g)===2Al2O3(s) ΔH=-3 350 kJ·mol-1
则2Al(s)+3FeO(s)===Al2O3(s)+3Fe(s)的ΔH是
A.-859 kJ·mol-1 B.+859 kJ·mol-1
C.-1 403 kJ·mol-1 D.-2 491 kJ·mol-1
难度: 中等查看答案及解析
-
下列说法正确的是
A.在101 kPa时,1 mol H2完全燃烧生成液态水,放出285.8 kJ热量,H2的燃烧热为-285.8 kJ·mol-1
B.测定HCl和NaOH反应的中和热时,每次实验均应测量3个温度,即盐酸起始温度,NaOH起始温度和反应后终止温度
C.在101 kPa时,1 mol C与适量O2反应生成1 mol CO时,放出110.5 kJ热量,则C的燃烧热为110.5 kJ·mol-1
D.在稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.31 kJ·mol-1。若将含0.5 mol H2SO4的浓硫酸与含1 mol NaOH的溶液混合,放出的热量等于57.3 kJ
难度: 中等查看答案及解析
-
最近意大利罗马大学的Fulvio Cacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,已知断裂1 mol N—N键吸收167 kJ热量,生成1 mol N≡N键放出942 kJ热量。根据以上信息和数据,则1 mol N4生成N2的ΔH为

A.+882 kJ·mol-1 B.+441 kJ·mol-1
C.-882 kJ·mol-1 D.-441 kJ·mol-1
难度: 中等查看答案及解析
-
炽热的炉膛内有反应:
C(s)+O2(g)===CO2(g) ΔH=-392 kJ·mol-1,
往炉膛内通入水蒸气时,有如下反应:
C(s)+H2O(g)===CO(g)+H2(g) ΔH=+131 kJ·mol-1,
CO(g)+1/2O2(g)===CO2(g) ΔH=-282 kJ·mol-1,
H2(g)+1/2O2(g)===H2O(g)ΔH=-241 kJ·mol-1,
由以上反应推断往炽热的炉膛内通入水蒸气时
A.既能使炉火更旺,又能节省燃料
B.虽不能使炉火更旺,但可以节省燃料
C.不能节省燃料,但能使炉火瞬间更旺
D.既不能使炉火更旺,又不能节省燃料
难度: 中等查看答案及解析
-
已知:①2CO(g)+O2(g)===2CO2(g) ΔH=-568 kJ·mol-1
②H2(g)+1/2O2(g)===H2O(g) ΔH=-248 kJ·mol-1
已知CO和H2的混合物1 mol在氧气中充分燃烧放出的热量272 kJ,则该混合气体中CO和氢气的物质的量的比值为
A.1∶1 B.3∶37
C.2∶1 D.3∶2
难度: 中等查看答案及解析
-
氯原子对O3分解有催化作用:
O3+Cl===ClO+O2 ΔH1
ClO+O===Cl+O2 ΔH2
大气臭氧层的分解反应是:O3+O===2O2 ΔH,该反应的能量变化如图:
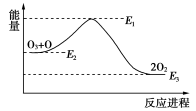
下列叙述中,正确的是
A.反应O3+O==2O2的ΔH=E1-E3
B.O3+O===2O2是吸热反应
C.ΔH=ΔH1+ΔH2
D.大气层中的臭氧无法再生
难度: 中等查看答案及解析
-
一些盐的结晶水合物,在温度不太高时就有熔化现象,即熔溶于自身的洁净水中,又同时吸收热量。他们在塑料袋中经日晒就熔化,又在日落后缓慢凝结而释放热量。故可用于调节室内温度,或用作夏日防暑的枕垫或坐垫,这些物质可称之为热材料。现有几种盐的结晶水合物有关数据如下:
①Na2S2O3·5H2O
②CaCl2·6H2O
③Na2SO4·10H2O
④Na2HPO4·10H2O
熔点/℃
40~50
29.92
32.38
35.1
熔化热/kJ·mol-1
49.7
37.3
77
100.1
根据上述数据和实用性考虑,实际运用时常采用的物质应该是
A.① B.②
C.③ D.④
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1;Na2O2 (s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是
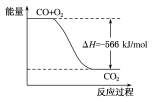
A.CO的燃烧热为283 kJ
B.如图可表示由CO生成CO2的反应过程和能量关系
C.2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g)ΔH>-452 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
