-
一种充电电池放电时的电极反应为 H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH- 。当为电池充电时,与外电源正极连接的电极上发生的反应是( )
A. H2O的还原 B. NiO(OH)的还原
C. H2的氧化 D. Ni(OH) 2的氧化
难度: 简单查看答案及解析
-
下列对热化学方程式
H2(g)+
I2(g)══HI(g) ΔΗ="+26" kJ·mol-1的叙述中,正确的是
A. 1 mol氢气和1 mol碘蒸气完全反应需要吸收26 kJ的热量
B. 1个氢分子和1个碘分子完全反应需要吸收52 kJ的热量
C. 1 mol H2(g)与1 mol I2(g)完全反应生成2 mol的HI气体需吸收52 kJ的热量
D.
mol H2(g)与
mol I2(g)完全反应放出26 kJ的热量
难度: 中等查看答案及解析
-
已知:
(1)Zn(s)+
O2(g)===ZnO(s) ΔH=-348.3 kJ·mol-1
(2)2Ag(s)+
O2(g)===Ag2O(s) ΔH=-31.0 kJ·mol-1
则Zn(s)+Ag2O(s)===ZnO(s)+2Ag(s)的ΔH等于( )
A. -317.3 kJ·mol-1 B. -379.3 kJ·mol-1
C. -332.8 kJ·mol-1 D. +317.3 kJ·mol-1
难度: 中等查看答案及解析
-
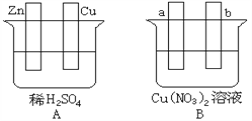
关于下图所示的原电池,下列说法正确的是
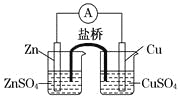
A. 电子沿着盐桥从锌电极流向铜电极
B. 盐桥中的阳离子向硫酸铜溶液中迁移
C. 电流从锌电极通过电流计流向铜电极
D. 铜电极上发生的电极反应是2H++2e-===H2↑
难度: 中等查看答案及解析
-
下列叙述正确的是( )
A. 电解池将化学能转化为电能
B. 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应
C. 用惰性电极电解饱和NaCl溶液一段时间后,若 通入氯化氢气体,能使电解液恢复到原状态
D. 用惰性电极电解Na2SO4溶液,阴阳两极气体产物的物质的量之比为1:2
难度: 中等查看答案及解析
-
用惰性电极电解下列溶液一段时间后再加入一定量的某种物质(方括号内物质),能够使溶液恢复到原来的成分和浓度的是( )
A. AgNO3 [AgNO3] B. NaOH [H2O]
C. KCl [KCl] D. CuSO4 [Cu(OH)2]
难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是
A.在铁门上焊接铜块能防腐蚀
B.镀锡铁制品的镀层破损后,镀层仍能对铁制品起保护作用
C.钢柱在水下部分比在空气与水交界处更容易腐蚀
D.在海轮外壳连接锌块,保护外壳不受腐蚀是采用了牺牲阳极的阴极保护法
难度: 中等查看答案及解析
-
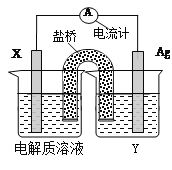
某小组为了研究电化学原理设计了如图所示的装置,下列说法中错误的是
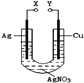
A. X和Y不连接时,铜棒上会有金属银析出
B. X和Y用导线连接时,银棒是正极,发生氧化反应
C. 若X接直流电源的正极,Y接负极,Ag+向铜电极移动
D. 无论X和Y是否用导线连接,铜棒均会溶解,溶液都从无色逐渐变成蓝色
难度: 中等查看答案及解析
-
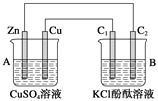
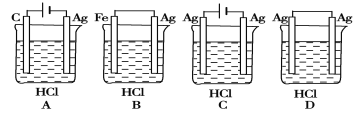
某学生根据反应2HCl+2Ag === 2AgCl+H2↑的原理,设计了下图所示的四个装置,你认为合理的是
难度: 中等查看答案及解析
-
研究电化学腐蚀及防护的装置如右图所示。下列有关说法错误的是( )

A. d为石墨,铁片腐蚀加快
B. d为石墨,石墨上电极反应为:O2 + 2H2O + 4e == 4OH–
C. d为锌块,铁片不易被腐蚀
D. d为锌块,铁片上电极反应为:2H+ + 2e == H2↑
难度: 中等查看答案及解析
-
锌铜原电池装置如图所示,其中阳离子交换膜只允许阳离子和水分子通过,下列有关叙述正确的是( )

A. 铜电极上发生氧化反应
B. 电池工作一段时间后,甲池的c(SO42-)减小
C. 电池工作一段时间后,乙池溶液的总质量增加
D. 阴阳离子离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡
难度: 中等查看答案及解析
-
将NaCl溶液滴在一块光亮清洁的铁板表面上,一段时间后发现液滴覆盖的圆周中心区(a)已被腐蚀而变暗,在液滴外沿形成棕色铁锈环(b),如图所示。导致该现象的主要原因是液滴之下氧气含量比边缘少。下列说法正确的是( )
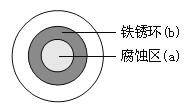
A. 液滴中的Cl―由a区向b区迁移
B. 液滴边缘是正极区,发生的电极反应为:O2+2H2O+4e-=4OH-
C. 液滴下的Fe因发生还原反应而被腐蚀,生成的Fe2+由a区向b区迁移,与b区的OH―形成Fe(OH)2,进一步氧化、脱水形成铁锈
D. 若改用嵌有一铜螺丝钉的铁板,在铜铁接触处滴加NaCl溶液,则负极发生的电极反应为:Cu-2e-=Cu2+
难度: 中等查看答案及解析
-
铁镍蓄电池又称爱迪生电池,放电时的总反应为:Fe+Ni2O3+3H2O=Fe(OH)2+2Ni(OH)2。下列有关该电池的说法不正确的是( )
A. 电池的电解液为碱性溶液,正极为Ni2O3、负极为Fe
B. 电池放电时,负极反应为Fe+2OH--2e-=Fe(OH)2
C. 电池充电过程中,阴极附近溶液的pH降低
D. 电池充电时,阳极反应为2Ni(OH)2+2OH--2e-=Ni2O3+3H2O
难度: 中等查看答案及解析
-
以KCl和ZnCl2混合液为电镀液在铁制品上镀锌,下列说法正确的是( )
A. 未通电前上述镀锌装置可构成原电池,电镀过程是该电池的充电过程
B. 因部分电能转化为热能,电镀是通过的电量与锌的析出量无确定关系
C. 电镀时保持电流恒定,升高温度不改变电解反应速率
D. 镀锌层破损后即对铁制品失去保护作用
难度: 中等查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为 3Zn + 2K2FeO4+ 8H2O
3Zn(OH)2+ 2Fe(OH)3+ 4KOH下列叙述不正确的是( )
A. 放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B. 充电时阳极反应为:Fe(OH)3-3e-+ 5 OH-= FeO42-+ 4H2O
C. 放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
D. 放电时正极附近溶液的碱性增强
难度: 简单查看答案及解析
-
按如下图装置进行电解实验:A极是铜锌合金,B极为纯铜。电解质中含有足量的铜离子。通电一段时间后,若A极恰好全部溶解,此时B极质量增加7.68 g,溶液质量增加0.04 g,则合金中Cu、Zn原子个数比为( )
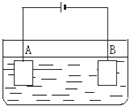
A. 1∶1 B. 2∶1 C. 3∶1 D. 4∶1
难度: 中等查看答案及解析
-
微生物电池是指在微生物的作用下将化学能转化为电能的装置,其工作原理如图所示。下列有关微生物电池的说法错误的是
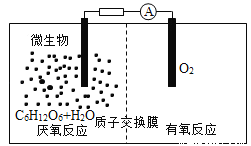
A. 正极反应中有CO2生成 B. 微生物促进了反应中电子的转移
C. 质子通过交换膜从负极区移向正极区 D. 电池总反应为C6H12O6+6O2═6CO2+6H2O
难度: 简单查看答案及解析
-
关于铅蓄电池的说法正确的是 ( )。
A. 在放电时,正极发生的反应是Pb(s)+SO42-(aq)-2e-=PbSO4(s)
B. 在放电时,该电池的负极材料是铅板
C. 在充电时,电池中硫酸的浓度不断变小
D. 在充电时,阳极发生的反应是PbSO4(s)+2e-=Pb(s)+SO42-(aq)
难度: 简单查看答案及解析
-
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得溶液中加入0.2molCu(OH) 2后恰好恢复到电解前的浓度和pH。则电解过程中转移的电子数为( )
A. 1.0mol B. 0.8mol C. 0.6mol D. 0.4mol
难度: 中等查看答案及解析
-
某原电池装置如图所示,电池总反应为2Ag+Cl2=2AgCl。下列说法正确的是( )
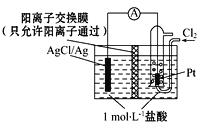
A. 正极反应为AgCl+e-=Ag + Cl-
B. 放电时,交换膜右侧溶液中有大量白色沉淀生成
C. 若用NaCl溶液代替盐酸,则电池总反应随之改变
D. 当电路中转移0.01 mol e-时,交换膜左侧溶液中约减少0.02 mol离子
难度: 困难查看答案及解析