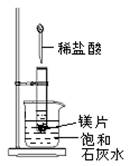
-
19世纪中叶,门捷列夫的突出贡献是
A.提出原子学说 B.发现元素周期律
C.提出分子学说 D.发现氧气
【解析】考查化学史。提出原子学说是道尔顿,提出分子学说的是阿伏加德罗。最早发现氧气的是舍勒,所以答案是B。
难度: 简单查看答案及解析
-
21世纪人类正由“化石能源时代逐步向多能源时代”过渡,下列不属于新能源的是
A.电力 B.核能 C.太阳能 D.氢能
【解析】电力一般要靠火力发电或水力发电,不属于新能源,B、C、D均属于新能源。
难度: 简单查看答案及解析
-
不同元素的原子
A.质子数一定不等 B.中子数一定不等
C.质量数一定不等 D.核外电子数一定相等
【解析】具有相同核电荷数的(即质子数)的一类原子叫元素,因此不同元素的原子质子数是一定不相同的,选项A正确。B、C、D则不一定相等。
难度: 简单查看答案及解析
-
下列各组微粒中互为同位素是
A.
与
B.T2O与H2O
C.
与
D.O2与O3
【解析】质子数相同质量数不同的同一元素的不同核素互成为同位素。A中质子数不同,B和D中是具体的物质而不是核素,选项C中质子数相同,质量数不同,所以互成为同位素。
难度: 简单查看答案及解析
-
某元素的原子的最外层电子数是其次外层电子数的3倍,则此元素是
A.硫 B.碳 C.氧 D.铝
【解析】考查原子核外电子的排布。因为元素原子的最外层电子数不超过8(K层为最外层时不超过2个),所以最外层电子数是其次外层电子数的3倍的原子只能是两层,因此是氧元素。
难度: 简单查看答案及解析
-
下列说法错误的是
A.含有离子键的化合物一定是离子化合物
B.含有共价键的化合物一定是共价化合物
C.离子化合物中可能含有共价键
D.共价化合物中一定不含有离子键
【解析】考查化学键和化合物的关系。含有离子键的化合物一定是离子化合物,全部由共价键形成的化合物是共价化合物。因此离子化合物中可以有共价键,但共价化合物中绝对不能出现离子键。需要注意的是只含有共价键的物质不一定是共价化合物,也可能是单质,所以选项B是错误的。
难度: 简单查看答案及解析
-
今年3月11日发生在日本近海的9.0级地震使日本福岛第一核电站2号机组发生爆炸,放射性物质131 53I扩散到周围环境中引发了放射性污染,下列有关131 53I叙述正确的是
A.131 53I是碘的一种同素异形体
B.131 53I是一种新发现的元素
C.131 53I位于元素周期表中第4周期ⅦA族
D.131 53I核内的中子数与核外电子数之差为25
【解析】考查原子的组成。在表示原子的组成时,元素符号的左下角表示质子数,左上角表示质量数。因此131 53I表示质子数为53,质量数是131的一种核素,含有的中子数是131-53
难度: 简单查看答案及解析
-
下列电子式或结构式错误的是

【解析】在CCl4中每个氯原子还有三对电子对没有参与成键,所以正确的电子式为
,因此选项C是错误的,答案选C。
难度: 简单查看答案及解析
-
下图各装置中(电解质溶液均为硫酸),不能构成原电池的是

难度: 简单查看答案及解析
-
下列过程中,需要减慢化学反应速率的是
A.炼钢 B.炼铁
C.合成纤维 D.食物腐败
【解析】食物的腐败会影响食物的使用,增加成本,浪费资源,所以答案选D。
难度: 简单查看答案及解析
-
下列各组中顺序的排列不正确的是
A.酸性:HClO4>H2SO4>H3PO4>H2SiO3 B.稳定性:HF>H2O>H2S
C.碱性:KOH >NaOH >Mg(OH)2 D.熔沸点:HI>HBr>HCl>HF
【解析】考查元素周期律的应用。同周期元素自左向右金属性逐渐减弱,非金属性逐渐增强。同主族元素自上而下金属性逐渐增强,非金属性逐渐减弱。金属性越强相应最高价氧化物的水化物的碱性就越强。非金属性越强,相应氢化物的稳定性就越强,最高价氧化物对应水化物的酸性就越强,因此选项ABC均正确。应用HF分子中存在氢键,所以其熔沸点在四种氢化物中是最高的,正确的顺序为HF>HI>HBr>HCl。答案选D。
难度: 简单查看答案及解析
-
氨分解反应(2NH3
N2+3H2)在容积为2 L的密闭容器内进行,已知起始时氨气的物质的量为4 mol,5 s末为2.4 mol,则用氨气表示该反应的反应速率为
A.0.32 mol/(L·s) B.0.16 mol/(L·s)
C.1.6 mol/(L·s) D.0.8 mol/(L·s)
【解析】反应速率通常用单位时间内浓度的变化量来表示。反应进行到5s时,消耗的氨气是4mol-2.4mol=1.6mol,所以用氨气表示的反应速率是
,所以选项B是正确的。答案选B。
难度: 简单查看答案及解析
-
同一周期的两主族元素A、B能形成AB2型离子化合物,A、B元素在周期表中的族序数可能为
A.ⅡA、ⅦA B.IA、ⅦA C.ⅣA、ⅥA D.IA、VA
【解析】AB2型离子化合物,说明A和B的化合价应是+2价和-1价,因此在主族元素符合条件的应该位于ⅡA和 ⅦA。即选项A是正确的。答案选A。
难度: 简单查看答案及解析
-
A、B、C都是金属:B中混有C时,只有C能被盐酸溶解;A与B组成原电池时,A为电池的正极。A、B、C三种金属的活动性顺序为
A.A>B>C B.A>C>B C.C>B>A D.B>C>A
【解析】考查金属活泼性比较。金属越活泼,越可以被盐酸溶解,所以C大于B。在原电池中较活泼的金属作负极,不活泼的金属作正极,所以B大于A。因此活动性顺序为C>B>A。答案选C。
难度: 简单查看答案及解析
-
已知反应X+Y=M+N为放热反应,对该反应的下列说法中一定正确的是
A. X的能量一定高于M
B. Y的能量一定高于N
C. X和Y的总能量一定高于M和N的总能量
D. 因该反应为放热反应,故不必加热就可发生
【解析】考查放热反应的概念。若反应物的总能量高于生成物的总能量,则反应是放热反应。但反应条件和反应是放热反应还是吸热反应无关,所以正确的答案是C。
难度: 简单查看答案及解析
-
下面关于化学反应的限度的叙述中,不正确的是
A.任何可逆反应都有一定的限度
B.化学反应达到限度时,正逆反应速率相等
C.化学反应的限度可以通过改变条件而改变
D.当一个化学反应在一定条件下达到限度时,反应即停止
【解析】化学反应的限度只适用于可逆反应,A正确。在一定条件下,当可逆反应中正反应速率和逆反应速率相等时,体系中各种物质的浓度和含量均不再发生变化,此时可逆反应达到了该条件下的限度。当外界条件发生变化时,限度将发生相应的变化。所以选项B和C正确。达到限度时,正逆反应速率限度,但并不等于0,所以选项D是错误的。答案选D。
难度: 简单查看答案及解析