-
原子电子层数相同的X 、Y、Z三种元素,若最高价氧化物的水化物酸性强弱为H3XO4<H2YO4<HZO4,则下列判断正确的是( )
A. 非金属性强弱为X>Y>Z B. 原子半径为X<Y<Z
C. 阴离子的还原性为,X3->Y2->Z- D. 气态氢化物的稳定性为H3X>H2Y>HZ
难度: 中等查看答案及解析
-
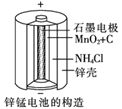
碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l)==Zn(OH)2(s)+Mn2O3(s),下列说法错误的是:
A. 电池工作时,锌失去电子
B. 电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e—=Mn2O3(s)+2OH—(aq)
C. 电池工作时,电子由正极通过外电路流向负极
D. 外电路中每通过0.2mol电子,锌的质量理论上减小6.5g
难度: 中等查看答案及解析
-
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色的Cr3+。下列对乙醇的描述与此测定原理有关的是( )
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧衍生物
A. ②④ B. ②③ C. ①③ D. ①④
难度: 中等查看答案及解析
-
构建和谐社会的总要求之一是人与自然和谐相处,下列做法不符合这一主题的是
A.中科院广州化学所在利用二氧化碳制取可降解塑料的技术方面处于世界领先水平,该技术的成功应用将有效改善以二氧化碳为主的温室气体引发的“厄尔尼诺”、“拉尼娜”等全球气候异常现象
B.许多国家对聚乙烯等塑料垃圾进行了深埋或者倾倒入海处理,达到消除“白色污染”的目的
C.山东单县采用以杂草、秸秆等为原料的生物质发电,有效地减少了二氧化硫的排放
D.汽油中掺入酒精使用,可以降低对环境的污染和节约能源
难度: 中等查看答案及解析
-
某课外小组将海带的灰烬浸泡后过滤,得到澄清的滤液,他们设计了如下几个方案,你认为能证明灼烧海带的灰烬中含有碘元素的是
A. 取适量滤液,蒸干,观察是否有紫色固体生成
B. 取适量滤液,加入苯,振荡、静置,苯层无色,证明不含碘元素
C. 取适量滤液,向其中加入淀粉溶液,无明显现象,证明不含碘元素
D. 取适量滤液,加入酸化的H2O2,再加入淀粉溶液,呈蓝色,证明含有碘元素
难度: 中等查看答案及解析
-
下列说法正确的是
A. 物质发生化学反应时都伴随着能量变化,伴随能量变化的物质变化一定是化学变化
B. 需要加热的化学反应一定是吸热反应,不需要加热就能进行的反应一定是放热反应
C. 吸热反应就是反应物的总能量比生成物的总能量高;也可以理解为化学键断裂时吸收的能量比化学键形成时放出的能量多
D. 因为3O2(g)=2O3(g)是吸热反应,所以臭氧比氧气的化学性质更活泼
难度: 中等查看答案及解析
-
在如图所示装置中,观察到电流计指针偏转;M棒变粗,N棒变细,由此判断下表中所列的M、N、P物质,其中可以成立的是
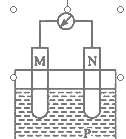
选项
M
N
P
A
锌
铜
稀硫酸溶液
B
铜
铁
稀盐酸
C
银
锌
硝酸银溶液
D
锌
铁
硝酸银溶液
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
从南方往北方长途运输水果时,常常将浸泡有高锰酸钾溶液的硅藻土放置在盛放水果的容器中,其目的是
A.利用高锰酸钾溶液杀死水果周围的细菌,防止水果霉变
B.利用高锰酸钾溶液吸收水果周围的氧气,防止水果腐烂
C.利用高锰酸钾溶液的氧化性,催熟水果
D.利用高锰酸钾溶液吸收水果产生的乙烯,防止水果早熟
难度: 中等查看答案及解析
-
反应A+3B=4C+2D,在不同条件下反应,其平均反应速率v(X)(表示反应物的消耗速率或生成物的生成速率)如下,其中反应速率最快的是
A. v(A)=0.4mol/(L·s) B. v(B)=0.8mol/(L·s)
C. v(C)=1.2mol/(L·s) D. v(D)=0.7mol/(L·s)
难度: 中等查看答案及解析
-
将淀粉水解,并用新制氢氧化铜悬浊液检验其水解产物的实验中,要进行的主要操作是:①加热;②滴入稀硫酸;③加入新制的氢氧化铜悬浊液;④加入足量的氢氧化钠溶液。以上各步操作的先后顺序排列正确的是
A. ①②③④① B. ②①④③①
C. ②④①③① D. ③④①②①
难度: 中等查看答案及解析
-
金属锂是密度最小的金属,等质量的不同金属,锂可以释放出更多电子,故常用来制造高性能电池。已知锂的金属性介于钠和镁之间,则冶炼金属锂应采用的方法是
A. 电解法 B. 热还原法 C. 热分解法 D. 铝热法
难度: 中等查看答案及解析
-
鉴别乙醇、苯和CCl4最简单的方法是( )
A. 加酸性高锰酸钾溶液后振荡,静置
B. 与乙酸在有浓硫酸存在的条件下加热
C. 加蒸馏水后震荡静置
D. 加硝酸银溶液后振荡静置
难度: 中等查看答案及解析
-
若甲烷与氯气以1:1混合,在光照下反应得到的产物有
①CH3Cl ②CH2Cl2 ③CHCl3 ④CCl4
A.只有① B.只有③
C.①②③的混合物 D.①②③④的混合物
难度: 中等查看答案及解析
-
食盐(NaCl)是生活中常用的调味品,HCl是胃酸的主要成分,下列关于两种物质的说法正确的是( )
A. 炒菜时放入食盐并不破坏NaCl中的化学键
B. HCl的电子式是H+
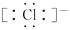
C. NaCl熔化时破坏共价键
D. HCl的结构式是H—Cl
难度: 中等查看答案及解析
-
对于可逆反应2A(g)+3B(g)
3C(g),在一定条件下,使一定量A和B气体反应,达到平衡状态时,具有的关系是
A. 各物质的量浓度之比为c(A):c(B):c(C)=2:3:3
B. 平衡混合物体积是反应开始前的3/5
C. 平衡混合物中各物质的量浓度相等
D. 单位时间内,若消耗了a mol A物质,则同时也消耗了1.5a mol C物质
难度: 中等查看答案及解析
-
化学反应A2+B2=2AB的能量变化如图所示,则下列说法正确的是
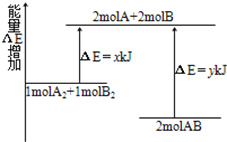
A. 该反应是吸热反应
B. 断裂1molA-A键和1molB-B键共放出xkJ能量
C. 断裂2molA-B键需要吸收ykJ能量
D. 2molAB的总能量高于1molA2和1molB2的总能量
难度: 中等查看答案及解析
-
可逆反应N2+3H2
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A. 3v正(N2)=v正(H2) B. v正(N2)=v逆(NH3)
C. 2v正(H2)=3v逆(NH3) D. v正(N2)=3v逆(H2)
难度: 中等查看答案及解析
-
用于制造隐形飞机的某种物质具有吸收微波的功能,其主要成分的结构如下图,下列说法正确的是
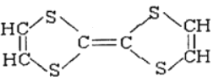
A.该物质属于烃类
B.该物质易溶于水
C.该物质能使酸性高锰酸钾溶液褪色
D.该物质是一种高分子化合物
难度: 中等查看答案及解析
-
一定质量的甲烷燃烧后的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓慢经过无水CaCl2时,CaCl2增重25.2 g。原混合气体中CO2的质量为( )
A. 12.5 g B. 13.2 g C. 19.7 g D. 24.4 g
难度: 中等查看答案及解析
-
一定条件下,在体积为10L的固定容器中发生的反应:N2+3H2
2NH3,反应过程如下图所示,下列说法正确的是
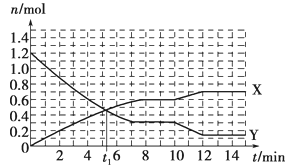
A. t1 min时正、逆反应速率相等
B. X曲线表示NH3的物质的量随时间变化的关系
C. 0~8 min,H2的平均反应速率v(H2)=0.75 mol·L-1·min-1
D. 10~12 min,N2的平均反应速率为v(N2)=0.25mol·L-1·min-1
难度: 中等查看答案及解析