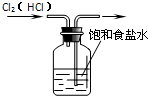
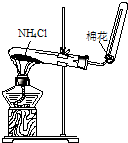
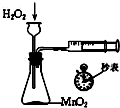
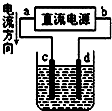
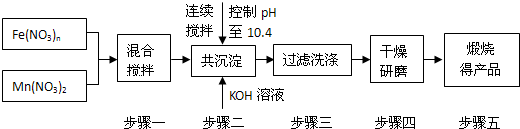
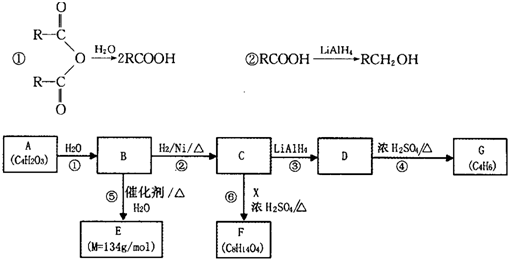
-
由短周期元素组成的化合物X是某抗酸药的有效成分.甲同学欲探究X的组成.
查阅资料:
①由短周期元素组成的抗酸药的有效成分有碳酸氢钠、碳酸镁、氢氧化铝、硅酸镁铝、磷酸铝、碱式碳酸镁铝.
②Al3+在pH=5.0时沉淀完全;Mg2+在pH=8.8时开始沉淀,在pH=11.4时沉淀完全.
实验过程:
I.向化合物X粉末中加入过量盐酸,产生气体A,得到无色溶液.
Ⅱ.用铂丝蘸取少量I中所得的溶液,在火焰上灼烧,无黄色火焰.
Ⅲ.向I中所得的溶液中滴加氨水,调节pH至5~6,产生白色沉淀B,过滤.
Ⅳ.向沉淀B中加过量NaOH溶液,沉淀全部溶解.
Ⅴ.向Ⅲ中得到的滤液中滴加NaOH溶液,调节pH至12,得到白色沉淀C.
(1)I中气全A可使澄清石灰水变浑浊,A的化学式是________.
(2)由I、Ⅱ判断X一定不含有的元素是磷、________.
(3)Ⅲ中生成B的离子方程式是________.
(4)Ⅳ中B溶解的离子方程式是________.
(5)沉淀C的化学式是________.
(6)若上述n(A):n(B):n(C)=1:1:3,则X的化学式是________.难度: 中等查看答案及解析
-
在某温度下、容积均为1L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2SO2(g)+O2(g)
2SO3(g)△H=-196kJ/mol.初始投料与各容器达平衡时的有关数据如下:
(1)若初始投入amolSO2、bmolO2和cmolSO3,在相同条件下,要达到与甲相同的化学平衡,则a、c与b、c间应满足的代数关系式为________、________.实验 甲 乙 丙 初始投料 2molSO21molO2 2molSO3 4molSO22molO2 平衡时n(SO3) 1.6mol n2 n3 反应的能量变化 放出Q1kJ 吸收Q2kJ 放出Q3kJ 体系的压强 P1 P2 P3 反应物的转化率 α1 α2 α3
(2)该温度下此反应的平衡常数值为________,若在相同温度条件下起始投入0.1molSO2、0.1molO2、0.3molSO3,则反应开始时正逆反应速率的大小关系是V正________V 逆
(3)三个容器中的反应分别达平衡时各组数据关系正确的是________
A.α1+α2=1 B.Q1+Q2=196 C.α3<α1
D.P3<2P1=2P2E.n2<n3<3.2mol F.Q3=2Q1
(4)如图表示甲反应在t1时刻达到化学平衡,在t2时刻因改变某个条件而发生变化的情况,则t2时刻改变的条件可能是________或________.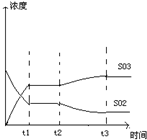
难度: 中等查看答案及解析
-
化学-选修物质结构与性质:
已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F.其中A原子核外有三个未成对电子;化合物B2E的晶体为离子晶体,E原子核外的M层中只有两对成对电子;C元素是地壳中含量最高的金属元素;D单质的晶体类型在同周期的单质中没有相同的;F原子核外最外层电子数与B相同,其余各层电子均充满.请根据以上信息,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A的简单氢化物分子中其中心原子采取________杂化,E的最高价氧化物分子的空间构型是________.
(2)B的氯化物的熔点比D的氯化物的熔点________(填高或低),理由是________.
(3)A、B、C、D的第一电离能由小到大的顺序为________.(用元素符号表示)
(4)A、F形成某种化合物的晶胞结构如右图所示(其中A显-3价),则其化学式为________;(每个球均表示1个原子)
(5)F的核外电子排布式是________,A、C形成的化合物具有高沸点和高硬度,是一种新型无机非金属材料,则其化学式为________.难度: 中等查看答案及解析
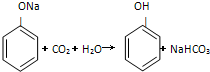 ,说明酸性:碳酸>苯酚
,说明酸性:碳酸>苯酚