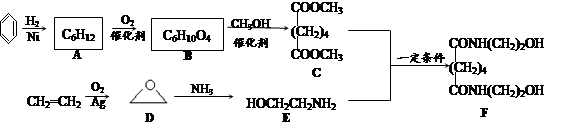-
我国科学家研制出一中催化剂,能在室温下高效催化空气中甲醛的氧化,其反应如下:
HCHO+O2
CO2+H2O。下列有关说法正确的是
A.该反应为吸热反应 B.CO2分子中的化学键为非极性键
C.HCHO分子中既含σ键又含π键 D.每生成1.8gH2O消耗2.24L O2
难度: 中等查看答案及解析
-
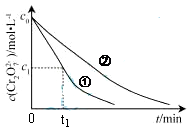
实验室中某些气体的制取、收集及尾气处理装置如图所示(省略夹持和净化装置)。仅用此装置和表中提供的物质完成相关实验,最合理的选项是
选项 a中的物质 b中的物质 c中收集的气体 d中的物质
A 浓氨水 CaO NH3 H2O
B 浓硫酸 Na2SO3 SO2 NaOH溶液
C 稀硝酸 Cu NO2 H2O
D 浓盐酸 MnO2 Cl2 NaOH溶液
难度: 中等查看答案及解析
-
下列分子或离子在指定的分散系中能大量共存的一组是
A.银氨溶液: Na+、K+、NO3-、NH3·H2O
B.空气: C2H2、CO2、SO2、NO
C.氢氧化铁胶体: H+、K+、S2-、Br-
D.高锰酸钾溶液: H+、Na+、SO42-、葡萄糖分子
难度: 困难查看答案及解析
-
热激活电池可用作火箭、导弹的工作电源。一种热激活电池的基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为:PbSO4+2LiCl+Ca = CaCl2+Li2SO4+Pb。下列有关说法正确的是
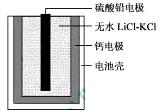
A.正极反应式:Ca + 2Cl--2e- = CaCl2
B.放电过程中,Li+向负极移动
C.没转移0.1mol电子,理论上生成20.7 g Pb
D.常温时,在正负极间接上电流表或检流计,指针不偏转
难度: 困难查看答案及解析
-
一定条件下,通过下列反应可以制备特种陶瓷的原料MgO, MgSO3(s) + CO(g)
MgO(s) + CO2(g) +SO2(g) △H>0。该反应在恒容的密闭容器中达到平衡后,若仅改变图中横坐标x的值,重新达到平衡后,纵坐标y随x变化趋势合理的是
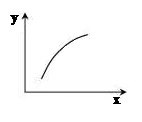
选项 x y
A 温度 容器内混合气体的密度
B CO的物质的量 CO2与CO的物质的量之比
C SO2的浓度 平衡常数K
D MgSO4的质量(忽略体积) CO的转化率
难度: 困难查看答案及解析
-
我省盛产矿盐(主要成分是NaCl,还好有SO42-等其他可溶性杂质的离子)。下列有关说法正确的是
A.有矿盐生成食盐,除去SO42-最合适的实际是Ba(NO3)2
B.工业上通过电解氯化钠溶液制备金属钠和氯气
C.室温下,AgCl在水中的溶解度小于在食盐中的溶解度
D.用酚酞试液可鉴别饱和食盐水和饱和纯碱溶液
难度: 中等查看答案及解析
-
已知NaHSO3溶液显酸性,溶液中存在以下平衡:
HSO3-+ H2O
H2SO3 + OH- ①
HSO3-
H+ + SO32- ②
向0.1mol·L-1的NaHSO3溶液中分别加入以下物质,下列有关说法正确的是
A.加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大
B.加入少量Na2SO3固体,则c(H+) + c(Na+) = c(HSO3-) + c(OH-) +
c(SO32-)
C.加入少量NaOH溶液,
、
的值均增大
D.加入氨水至中性,则2c(Na+) = c(SO32-)>c(H+) = c(OH-)
难度: 困难查看答案及解析