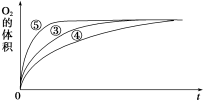
-
化学无处不在,下列与化学有关的说法正确的是
A.Si有良好的半导体性能,可直接用于制备光导纤维
B.淀粉、纤维素、蛋白质、油脂都是天然高分子化合物
C.用食醋可除去热水壶内壁的水垢
D.Cu的金属活泼性比Fe弱,故水库铁闸门上接装铜块可减缓铁腐蚀
难度: 中等查看答案及解析
-
下列关于物质分类的说法正确的是
A.C60、D2O、SiO2都属于化合物
B.漂白粉、石英、Fe(OH)3胶体都属于纯净物
C.BaSO4、NH4Cl、NaOH都属于强电解质
D.CO2、SO3、NO 都属于酸性氧化物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.1 mol 苯含有6 NA个C-H键
B.常温常压下,22.4 L H2O含有3NA个原子
C.1L 0.1 mol·L-1NaHCO3溶液中含有0.1NA个HCO3-
D.23g Na与足量H2O反应完全共转移2NA个电子
难度: 中等查看答案及解析
-
在下列给定条件的溶液中,一定能大量共存的离子组是
A.无色溶液中:K+、Cu2+、OH-、NO3-
B.含有大量Fe3+的溶液:Na+、Mg2+、I-、SCN-
C.pH=12的溶液中:K+、NH4+、SO42-、NO3-
D.水电离产生的c(OH-)=1×10-12mol·L-1的溶液中:K+、Na+、Cl-、NO3-
难度: 中等查看答案及解析
-
某羧酸酯的分子式为C10H18O3,1mol该酯完全水解可得到1mol羧酸和1mol乙醇,该羧酸的分子式为
A.C8H16O2 B.C8H16O3 C.C8H14O2 D.C8H14O3
难度: 中等查看答案及解析
-
下列陈述I、II正确并且有因果关系的是
选项
陈述I
陈述II
A
SO2和氯水有漂白性
两者都能使溴水褪色
B
CuSO4可以用作游泳池消毒剂
铜盐能使蛋白质变性
C
盐酸和氨水能溶解Al(OH)3
Al(OH)3是两性氢氧化物
D
用淀粉-KI溶液鉴别FeCl2
Fe2+有氧化性
难度: 中等查看答案及解析
-
下列说法正确的是
A.浓度为0.1mol·L-1 CH3COOH溶液,加水稀释,则
减小
B.浓度为0.1mol·L-1 CH3COOH溶液,升高温度,Ka (CH3COOH)不变,但醋酸的电离程度增大
C.在稀AgNO3溶液中先加入过量0.1mol/L NaCl溶液,再加入少量0.1mol/L Na2S溶液,先产生白色沉淀,后出现黑色沉淀,说明Ksp(AgCl)>Ksp(Ag2S)
D.在恒容密闭容器中,反应CO2(g)+3H2(g)
CH3OH(g)+H2O(g) △H<0达到平衡后,使用高效催化剂,正反应速率增加,逆反应速率减小,平衡正向移动
难度: 中等查看答案及解析
-
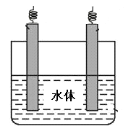
铜锌原电池(如图)工作时,下列叙述正确的是
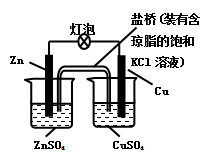
A.一段时间后,铜棒上有红色物质析出
B.正极反应为:Zn-2e-=Zn2+
C.在外电路中,电流从负极流向正极
D.盐桥中的K+移向ZnSO4溶液
难度: 中等查看答案及解析
-
四种短周期元素在周期表中的位置如图,其中只有M元素原子最外层电子数与电子层数相等,下列说法不正确的是
Y
Z
M
X
A.原子半径Z<M
B.非金属性:X<Z
C.M元素最高价氧化物对应水化物具有两性
D.Y的最高价氧化物对应水化物的酸性比X的弱
难度: 中等查看答案及解析
-
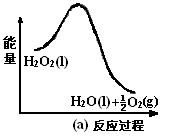
在298K、100kPa时,已知:2H2O(g)=O2(g)+2H2(g) △H1
Cl2(g)+H2(g)=2HCl(g) △H2
2Cl2(g)+2H2O(g)=4HCl(g)+O2(g) △H3
则△H3与△H1和△H2间的关系正确的是
A.△H3=△H1+2△H2 B.△H3=△H1+△H2
C.△H3=△H1-2△H2 D.△H3=△H1-△H2
难度: 中等查看答案及解析
-
下列实验现象预测正确的是
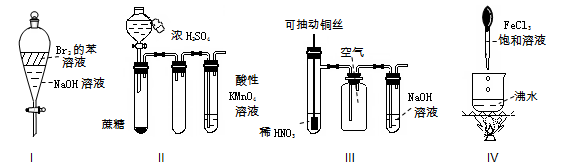
A.实验Ⅰ:振荡后静止,上层溶液颜色保持不变
B.实验Ⅱ:酸性KMnO4溶液中出现气泡,但颜色无变化
C.实验Ⅲ:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D.实验Ⅳ:煮沸溶液至红褐色,停止加热,光束通过体系时产生丁达尔效应
难度: 中等查看答案及解析
-
能正确表示下列反应的离子方程式是
A.稀硫酸中加入铜粉:Cu + 2H+ = Cu2+ + H2↑
B.用FeCl3溶液刻蚀铜制印刷电路板:Cu + Fe3+ = Cu2+ + Fe2+
C.向氢氧化钠溶液中通入过量CO2:CO2 + 2OH-= CO32-+ H2O
D.硫酸铝溶液中加入过量氨水:Al3+ + 3NH3·H2O = Al(OH)3↓+3NH4+
难度: 中等查看答案及解析
-
50℃时,下列各溶液中,离子的物质的量浓度关系正确的是
A.在稀硫酸中加入少量氢氧化钠固体,溶液导电性增强
B.饱和碳酸钠溶液中:c(Na+) = 2c(CO32-)
C.饱和食盐水中:c(Na+) + c(OH-) = c(Cl-) + c(H+)
D.pH=12的NaOH溶液中:c(OH-) =1.0×10-2 mol·L-1
难度: 中等查看答案及解析
-
下列有关实验操作、现象和解释或结论都正确的是
实验操作
现象
解释或结论
A
将等体积的CH4和Cl2装入硬质大试管混合后,再将试管倒置于饱和食盐水中,在漫射光的照射下充分反应
试管内气体颜色逐渐变浅,试管内壁出现油状液滴
甲烷与氯气在光照条件下发生了取代反应
B
向盛有溴水的两试管中分别加入一定量的乙烯和苯
两试管中的水层都逐渐褪色
乙烯和苯都与溴水发生了加成反应
C
向盛有少量无水乙醇的试管中,加入一小块新切的、用滤纸擦干表面煤油的金属钠
钠浮在无水乙醇表面,反应比钠在水中更剧烈
乙醇结构中羟基氢的活性比水中的强
D
取1mL 20%的蔗糖溶液,加入3~5滴稀硫酸。水浴加热5min后取少量溶液,直接加入少量新制Cu(OH)2,加热4min
未产生砖红色沉淀
蔗糖不能水解生成葡萄糖
难度: 中等查看答案及解析
-
(8分)下表是元素周期表的一部分, 针对表中的①~⑥元素,填写下列空白:
主族
周期
ⅠA
ⅡA
ⅢA
ⅣA
ⅤA
ⅥA
ⅦA
0族
二
①
三
②
③
④
⑤
⑥
(1)在这些元素中,化学性质最活泼的金属元素是:_______(填具体元素符号)。
(2)元素②与⑥形成的BA型化合物所含的化学键类型为:______键。
(3)元素④的单质制造的器具不能盛装碱性溶液也不能盛装酸性溶液,请写出元素④的单质与氢氧化钠溶液反应的离子方程式:__________。
(4)设计实验证明:元素①比元素⑤的非金属性强: 。
难度: 中等查看答案及解析
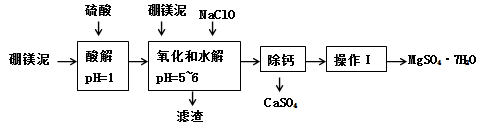



 ,写出反应②的反应方程式(标明反应条件):_____________。
,写出反应②的反应方程式(标明反应条件):_____________。
 可用来制备抗凝血药,通过下列路线合成:
可用来制备抗凝血药,通过下列路线合成: