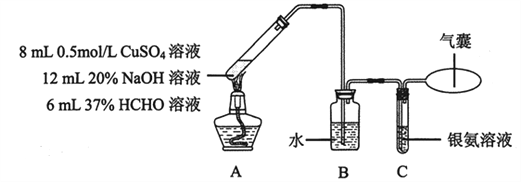
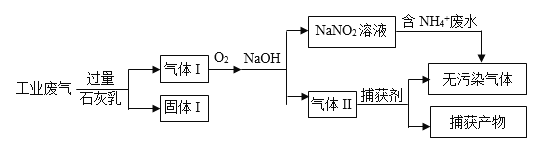
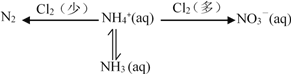-
下列有关性质的比较,不能用元素周期律解释的是
A. 金属性:Na > Mg B. 酸性:H2SO4 > HClO
C. 碱性:KOH > NaOH D. 热稳定性:HC1 > HBr
难度: 中等查看答案及解析
-
《本草衍义》中对精制砒霜过程有如下叙述:“取砒之法,将生砒就置火上,以器覆之,令砒烟上飞着覆器,遂凝结累然下垂如针,尖长者为胜,平短者次之”,文中涉及的操作方法是
A. 萃取 B. 蒸馏 C. 干馏 D. 升华
难度: 中等查看答案及解析
-
共建“一带一路”符合国际社会的根本利益,彰显人类社会的共同理想和美好追求。下列贸易商品中,主要成分属于无机物的是
A. 中国丝绸
B.捷克水晶
C.埃及长绒棉
D.乌克兰葵花籽油




A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列变化中,发生氧化还原反应的是
A. 用晶体Si制作半导体 B. 煅烧石灰石制备生石灰
C. 用Na2O2做呼吸面具供氧剂 D. 用可溶性铝盐处理水中悬浮物
难度: 中等查看答案及解析
-
下列解释事实的方程式不正确的是
A. 用Na2S处理含Hg2+废水:Hg2+ + S2− = HgS↓
B. 燃煤中添加生石灰减少SO2的排放:2CaO + O2 + 2SO2
2CaSO4
C. 工业上将Cl2 通入石灰乳中制漂白粉:Cl2 + OH- = Cl-+ ClO- + H2O
D. 向漂白液中加入适量洁厕灵(含盐酸),产生氯气:ClO-+ Cl-+2H+ = Cl2↑+ H2O
难度: 中等查看答案及解析
-
国际空间站处理CO2的一个重要方法是将CO2还原,所涉及的反应方程式为:CO2(g) + 4H2(g)
CH4(g) + 2H2O(g),若温度从300℃升至400℃,反应重新达到平衡时,H2的体积分数增加。下列关于该过程的判断正确的是
A. 该反应的ΔH < 0 B. 化学平衡常数K增大
C. CO2的转化率增加 D. 正反应速率增大,逆反应速率减小
难度: 中等查看答案及解析
-
下列制取SO2、验证其漂白性、收集并进行尾气处理的装置和原理能达到实验目的是

A. 制取SO2 B. 验证漂白性 C. 收集SO2 D. 尾气处理
难度: 中等查看答案及解析
-
在给定条件下,下列物质的转化能实现的是
A.

B.

C.

D.
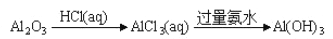
难度: 中等查看答案及解析
-
下列说法不正确的是
A. 乙醇的沸点高于丙烷
B. 氨基酸既能与盐酸反应,也能与NaOH反应
C. 室温下在水中的溶解度:乙二醇>苯酚>溴乙烷
D. 光照时异戊烷发生取代反应生成的一氯代物最多有5种
难度: 中等查看答案及解析
-
锂-空气电池由于具有较高的比能量而成为未来电动汽车的希望。其原理模型如图所示,下列说法不正确的是
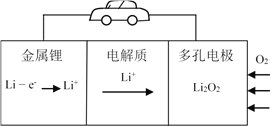
A. 可以用LiOH溶液做电解质溶液
B. 锂既是负极材料又是负极反应物
C. 正极反应为2Li+ + O2 + 2e-
Li2O2
D. 正极采用多孔碳材料是为了更好的吸附空气
难度: 中等查看答案及解析
-
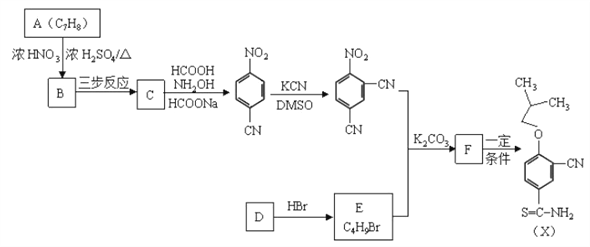
扁桃酸衍生物是重要的医药中间体,下列关于这种衍生物的说法正确的是
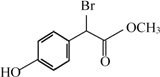
A. 分子式为C9H8O3Br
B. 不能与浓溴水反应生成沉淀
C. 与HCHO一定条件下可以发生缩聚反应
D. 1mol此衍生物最多与2mol NaOH发生反应
难度: 中等查看答案及解析
-
N2O和CO是环境污染性气体,可在Pt2O+ 表面转化为无害气体,其反应原理为N2O(g) + CO(g)
CO2(g) + N2(g) ΔH,有关化学反应的物质变化过程及能量变化过程如下。下列说法不正确的是
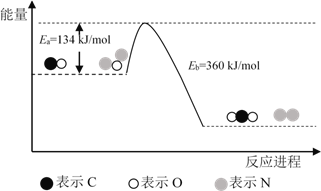
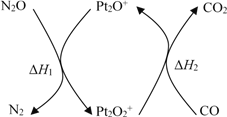
A. ΔH = ΔH1 + ΔH2
B. ΔH = −226 kJ/mol
C. 该反应正反应的活化能小于逆反应的活化能
D. 为了实现转化需不断向反应器中补充 Pt2O+ 和 Pt2O2+
难度: 中等查看答案及解析
-
可从铅蓄电池中回收铅,实现铅的再生。在工艺中得到含Na2PbCl4的电解液,电解Na2PbCl4溶液后生成Pb,如图所示。下列说法不正确的是
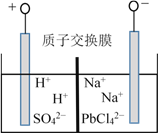
A. 阳极区会有气泡冒出,产生O2
B. 一段时间后,阳极附近pH明显增大
C. 阴极的电极反应方程式为PbCl42−+ 2e−
Pb + 4Cl-
D. Na2PbCl4浓度下降后可在阴极区加入PbO,实现电解液的继续使用
难度: 中等查看答案及解析
-
处理超标电镀废水,使其NaCN含量低于0.5 mg/L,即可达到排放标准,反应分两步进行。第一步NaCN与NaClO反应,生成NaOCN和NaCl。第二步NaOCN与NaClO反应,生成Na2CO3、CO2、NaCl和N2。已知HCN是弱酸,易挥发,有剧毒;HCN、HOCN中N元素的化合价相同。下列说法正确的是
A. 处理NaCN超标电镀废水的过程中无元素化合价的改变
B. 第一步反应溶液应调节为酸性,可避免生成有毒物质HCN
C. 第二步发生的反应为2OCN- + 3ClO-
2CO2↑ + CO32− + 3Cl- + N2↑
D. 处理100 m3含NaCN 10.3 mg/L的废水实际至少需要50 mol NaClO
难度: 困难查看答案及解析