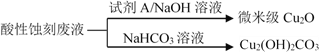-
工业上用蚀刻液浸泡铜板可制备印刷电路板,产生的蚀刻废液需要回收利用。
(1)应用传统蚀刻液(HCl-FeCl3)
①蚀刻铜板主要反应的离子方程式为________。
②该蚀刻液中加入一定量盐酸的目的为________,同时提高蚀刻速率。
③FeCl3型酸性废液处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+2Fe3+  3Fe2+、Fe+Cu2+
3Fe2+、Fe+Cu2+  Fe2++Cu,还有________、________。(用离子方程式表示)。
Fe2++Cu,还有________、________。(用离子方程式表示)。
(2)应用酸性蚀刻液(HCl-H2O2),产生的蚀刻废液处理方法如下:
①蚀刻铜板主要反应的离子方程式为________。
②回收微米级Cu2O过程中,加入的试剂A是______(填字母)。
a. Fe粉 b. 葡萄糖 c. NaCl固体 d.酸性KMnO4溶液
③回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________。
(3)应用碱性蚀刻液(NH3•H2O–NH4Cl) 蚀刻铜板,会有Cu(NH3)4Cl2和水生成。蚀刻铜板主要反应的化学方程式为________。
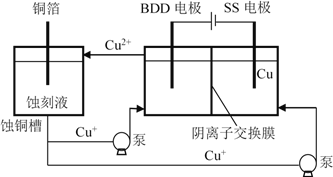
(4)与常规方法不同,有研究者用HCl-CuCl2做蚀刻液。蚀铜结束,会产生大量含Cu+废液,采用如图所示方法,可达到蚀刻液再生、回收金属铜的目的。此法采用掺硼的人造钻石BDD电极,可直接从水中形成一种具有强氧化性的氢氧自由基(HO•),进一步反应实现蚀刻液再生,结合化学用语解释CuCl2蚀刻液再生的原理________。
-
(10分)电子工业中,可用FeCl3—HCl溶液作为印刷电路铜板蚀刻液。某探究小组设计如下线路处理废液和资源回收:
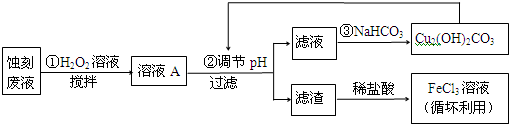
请回答:
(1)FeCl3—HCl溶液蚀刻铜板后的废液中含有的金属阳离子是 。
(2)FeCl3蚀刻液中加入盐酸的目的:可以 ,又可提高蚀刻速率。
(3)步骤①中加入H2O2溶液的目的是 。
(4)已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是 。
(5)写出步骤②中生成CO2的一个离子方程式_____(已知Cu2(OH)2CO3不易溶于水)。
(6)写出步骤③生成Cu2(OH)2CO3的离子方程式___________________。
-
(12分)近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
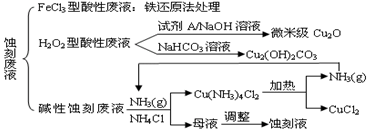
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 、 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 。
⑸ 碱性蚀刻液在蚀刻过程中发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 。
-
(18分)近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放。蚀刻液主要有酸性的(HCl—H2O2)、碱性的(NH3—NH4Cl)以及传统的(HCl—FeCl3)等3种。蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失。几种蚀刻废液的常用处理方法如下:
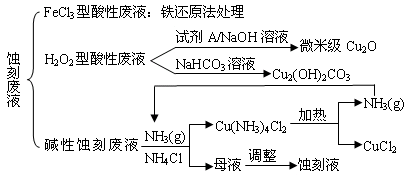
⑴ FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生。发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还
有 ▲ 、 ▲ 。(用离子方程式表示)。
⑵ HCl—H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:
▲ 。
⑶ H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的 ▲ (填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
⑷ 处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是 ▲ 。
⑸ 碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3·H2O+O2 = 2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是 ▲ 。
-
近年来,我国的电子工业迅速发展,造成了大量的电路板蚀刻废液的产生和排放.蚀刻液主要有酸性的(HCl-H2O2)、碱性的(NH3-NH4Cl)以及传统的(HCl-FeCl3)等3种.蚀刻废液中含有大量的Cu2+,废液的回收利用可减少铜资源的流失.几种蚀刻废液的常用处理方法如下:
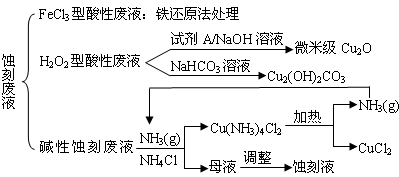
(1)FeCl3型酸性废液用还原法处理是利用Fe和Cl2分别作为还原剂和氧化剂,可回收铜并使蚀刻液再生.发生的主要化学反应有:Fe+Cu2+=Fe2++Cu、Fe+2H+=Fe2++H2↑,还有________、________.(用离子方程式表示).
(2)HCl-H2O2型蚀刻液蚀刻过程中发生的化学反应用化学方程式可表示为:________.
(3)H2O2型酸性废液处理回收微米级Cu2O过程中,加入的试剂A的最佳选择是下列中的________(填序号)
①酸性KMnO4溶液 ②NaCl(固) ③葡萄糖 ④甲醛
(4)处理H2O2型酸性废液回收Cu2(OH)2CO3的过程中需控制反应的温度,当温度高于80℃时,产品颜色发暗,其原因可能是________.
(5)碱性蚀刻液发生的化学反应是:2Cu+4NH4Cl+4NH3•H2O+O2=2Cu(NH3)4Cl2+6H2O,处理碱性蚀刻废液过程中加入NH4Cl固体并通入NH3的目的是________.
-
(18分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

按要求回答下列问题:
(1)废液①的主要含有的金属阳离子是_____(填化学符号,下同);废渣①的主要含有的物质是________;Y为_______。
(2)检验Z过量的方法是______________________________。
(3)写出废渣②生成二氧化硫的化学方程式___________________________。
(4)为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
(5)生产过程中调节溶液的pH不能过大的原因是____________________________。
(6)写出产生CuCl的离子方程式___________________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g加入10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;
②待样品溶解后,加水50ml和2滴指示剂;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 =CuCl2 + FeCl2;Fe2+ + Ce4+ = Fe3+ + Ce3+。则CuCl的纯度为____________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
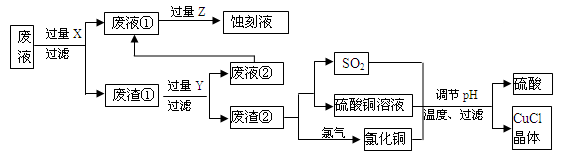
按要求回答下列问题:
⑴ 废液①的主要含有的金属阳离子是__________(填化学符号,下同);废渣①的成分是_____________,Y为__________。
⑵废液①与Z反应的离子方程式为:______________________。
⑶ 写出废渣②生成二氧化硫的化学方程式_____________________。
⑷ 为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
⑸ 生产过程中调节溶液的pH不能过大的原因是___________________。
⑹ 写出产生CuCl的离子方程式_______________________。
⑺ 氯化亚铜的定量分析:
① 称取样品0.25g加入10mL过量的FeCl3溶液250mlL锥形瓶中,不断摇动;
② 待样品溶解后,加水50mL和2滴指示剂;
③ 立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④ 重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 = CuCl2 + FeCl2; Fe2+ + Ce4+ = Fe3+ + Ce3+。
则CuCl的纯度为____________。
-
电子工业中,常用氯化铁溶液作为印刷电路铜板蚀刻液。请按要求回答下列问 题:
题:
(1)若向氯化铁溶液中加入一定量的澄清石灰水,调节溶液pH,可得红褐色沉淀,该反应的离子方程式为: ,该过程中调节溶液的pH为5,则c(Fe3+)为: mol·L-1。(己知:Ksp[Fe(OH)3]= 4.0×10-38)
(2)某探究小组设计如下线路处理废液和资源回收:
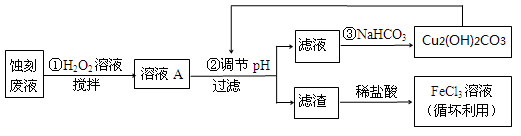
①用足量FeCl3溶液蚀刻铜板后的废液中含有的金属阳离子有: 。
② FeCl3蚀刻液中通常加入一定量的盐酸,其中加入盐酸的目的是: 。
③ 步骤①中加入H2O2溶液的目的是: 。
④ 已知:生成氢氧化物沉淀的pH
| Cu(OH)2 | Fe(OH)2 | Fe(OH)3 |
| 开始沉淀时 | 4.7 | 7.0 | 1.9 |
| 沉淀完全时 | 6.7 | 9.0 | 3.2 |
根据表中数据推测调节pH的范围是: 。
⑤ 写出步骤②中生成CO2的离子方程式: (已知Cu2(OH)2CO3难溶于水)
-
铁及其化合物在生产生活中有广泛应用。
(1) 可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向
可用作净水剂,也可用于无线电印刷电路做蚀刻剂。某化学兴趣小组利用如图所示装置向 的铁屑中通入
的铁屑中通入 生产无水
生产无水 。已知:
。已知: 固体呈黑棕色、易潮解、
固体呈黑棕色、易潮解、 左右时升华。
左右时升华。
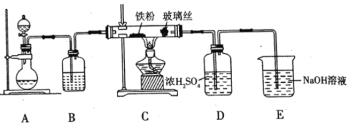
回答下列问题
①写出用高锰酸钾和浓盐酸在装置 中制备氯气的离子方程式_____。
中制备氯气的离子方程式_____。
②装置 中加入的试剂是_____,装置
中加入的试剂是_____,装置 中玻璃丝的作用是_____,
中玻璃丝的作用是_____, 中
中 溶液的作用是_____。
溶液的作用是_____。
③有同学认为气体通入装置 前应除去其中含有的
前应除去其中含有的 ,改进措施为_____。
,改进措施为_____。
(2)一种新型高效净水剂 (聚合氯化铁铝
(聚合氯化铁铝 ,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取
,广泛用于日常生活用水和工业污水的处理。某化工厂欲以工业生产废料(金属铁、铝及其氧化物)为原料制取 ,设计生产流程如下:
,设计生产流程如下:
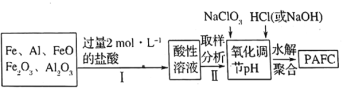
①实验室现需用 的稀盐酸,欲用
的稀盐酸,欲用 的浓盐酸配制,则所需浓盐酸体积为________。
的浓盐酸配制,则所需浓盐酸体积为________。
② 中
中 显________价,
显________价, 在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
在强酸性和强碱性溶液中均________稳定存在(填“能”或“不能”)。
③步骤Ⅱ中取样分析的目的是________。
A.测定溶液中 与
与 的含量比 B.测定原料是否完全溶解
的含量比 B.测定原料是否完全溶解
C.测定溶液中 的含量,以确定加入
的含量,以确定加入 的量 D.测定溶液中
的量 D.测定溶液中 的含量
的含量
-
废旧印刷电路板的回收利用可实现资源再生,并减少污染.废旧印刷电路板经粉碎分离,能得到非金属粉末和金属粉末.
(1)写出工业上制备印刷电路板原理的离子方程式:______
(2)下列处理印刷电路板非金属粉末的方法中,不符合环境保护理念的是______(填字母).
A.热裂解形成燃油 B.露天焚烧
C.作为有机复合建筑材料的原料 D.直接填埋
(3)用H2O2和H2SO4的混合溶液可溶出印刷电路板金属粉末中的铜.
写出在H2SO4溶液中Cu与H2O2 反应生成Cu2+ 和H2O的离子方程式______.
(4)控制其他条件相同,印刷电路板的金属粉末用10% H2O2和3.0mol•L-1 H2SO4的混合溶液处理,测得不同温度下铜的平均溶解速率(见下表).
| 温度(℃) | 20 | 30 | 40 | 50 | 60 | 70 | 80 |
| 铜平均溶解速率 | 7.34 | 8.01 | 9.25 | 7.98 | 7.24 | 6.73 | 5.76 |
当温度高于40℃时,铜的平均溶解速率随着反应温度升高而下降,其主要原因是______.
(5)在提纯后的CuSO4溶液中加入一定量的Na2SO3和NaCl溶液,加热,生成CuCl沉淀.制备CuCl的离子方程式是______ 2CuCl↓+SO42-+2H+
3Fe2+、Fe+Cu2+
Fe2++Cu,还有________、________。(用离子方程式表示)。