-
(18分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

按要求回答下列问题:
(1)废液①的主要含有的金属阳离子是_____(填化学符号,下同);废渣①的主要含有的物质是________;Y为_______。
(2)检验Z过量的方法是______________________________。
(3)写出废渣②生成二氧化硫的化学方程式___________________________。
(4)为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
(5)生产过程中调节溶液的pH不能过大的原因是____________________________。
(6)写出产生CuCl的离子方程式___________________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g加入10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;
②待样品溶解后,加水50ml和2滴指示剂;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 =CuCl2 + FeCl2;Fe2+ + Ce4+ = Fe3+ + Ce3+。则CuCl的纯度为____________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。下图是工业上用印刷电路的蚀刻液的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
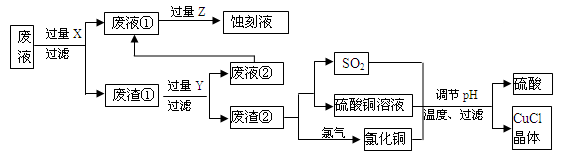
按要求回答下列问题:
⑴ 废液①的主要含有的金属阳离子是__________(填化学符号,下同);废渣①的成分是_____________,Y为__________。
⑵废液①与Z反应的离子方程式为:______________________。
⑶ 写出废渣②生成二氧化硫的化学方程式_____________________。
⑷ 为得到纯净的CuCl晶体,可用下列_________(填序号)进行洗涤。
a.纯净水 b.乙醇 c.稀硫酸 d.氯化铜溶液
⑸ 生产过程中调节溶液的pH不能过大的原因是___________________。
⑹ 写出产生CuCl的离子方程式_______________________。
⑺ 氯化亚铜的定量分析:
① 称取样品0.25g加入10mL过量的FeCl3溶液250mlL锥形瓶中,不断摇动;
② 待样品溶解后,加水50mL和2滴指示剂;
③ 立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;
④ 重复三次,消耗硫酸铈溶液平均体积为25.00mL。
已知:CuCl的分子式量为99;CuCl + FeCl3 = CuCl2 + FeCl2; Fe2+ + Ce4+ = Fe3+ + Ce3+。
则CuCl的纯度为____________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末,微溶于水、不溶于乙醇和稀硫酸。工业上用制作印刷电路的废液(含 、
、 、
、 、
、 )生产CuCl的流程如图所示:
)生产CuCl的流程如图所示:
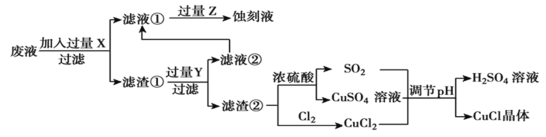
根据以上信息回答下列问题:
(1)生产过程中:X是______。(填化学式)
(2)写出生成CuCl的离子方程式______。
(3)析出的CuCl晶体不用水而用无水乙醇洗涤的原因是____。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是___________。
(5)CuCl的另一种制备原理是Cu2++Cu+2Cl-=2CuCl K=5.85×106,向0.01 mol∙L-1的CuCl2溶液中加入足量的铜,能否生成CuCl?(通过计算说明)_________。
(6)使用CuCl捕捉CO气体的反应为CuCl(s)+xCO(g)  CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
CuCl∙xCO(s) △H < 0,为提高CO的平衡转化率,可采取的措施有____(填标号)。
A 降低温度 B 增大压强 C 延长反应时间 D 把CuCl分散到疏松多孔的分子筛中
(7)已知:CuCl Cu++Cl- K1; CuCl+Cl-
Cu++Cl- K1; CuCl+Cl- CuCl2- K2;则反应Cu++2Cl-
CuCl2- K2;则反应Cu++2Cl- CuCl2-的平衡常数K=_______(用K1、K2表示)。
CuCl2-的平衡常数K=_______(用K1、K2表示)。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如图所示:
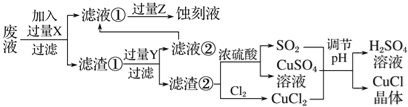
根据以上信息回答下列问题:
(1)写出生产过程中X________;Y________(填化学式)。
(2)析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________________;生产过程中调节溶液的pH不能过大的原因是________________________。
(3)写出生成CuCl的化学方程式:__________________________________。
(4)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是_________________。
(5)已知:常温下Ksp(CuCl)=1.6×10-7,Ksp(CuI)=1.2×10-12,现向CuCl饱和溶液中加入NaI固体至c(I-)=0.1mol/L,此时溶液中c(Cu+)/c(Cl-)=________。
(6)氯化亚铜的定量分析
①称取样品0.25 g置于已放入10 mL过量的FeCl3溶液的锥形瓶中,不断摇动。
②待样品溶解后,加水50 mL,邻菲罗啉指示剂2滴。
③立即用0.10 mol·L-1硫酸铈标准溶液滴定至终点,同时做空白实验一次。
已知:
CuCl+FeCl3===CuCl2+FeCl2;Fe2++Ce4+===Fe3++Ce3+。
如此再重复2次测得:
| 1 | 2 | 3 |
| 空白实验消耗硫酸铈 标准溶液的体积/mL | 0.75 | 0.50 | 0.80 |
| 0.25 g样品消耗硫酸铈 标准溶液的体积/mL | 24.65 | 25.75 | 24.90 |
④数据处理:计算得CuCl的纯度为_________(平行实验结果相差不能超过0.3%)。
-
[化学——选修2化学与技术](15分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:

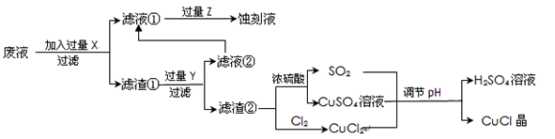
根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是_____,现代氯碱工业的装置名称是_____________________。
(2)写出生产过程中X__________Y__________(填化学式)。
(3)写出产生CuCl的化学方程式________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_______________;生产过程中调节溶液的pH不能过大的原因是_____________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是______。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_______。
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ =Fe3+ + Ce3+ 如此再重复二次测得:
| 1 | 2 | 3 |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为_________(平行实验结果相差不能超过0.3%)
-
(14分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
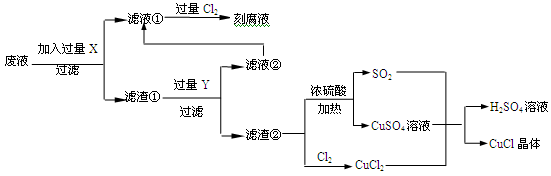
(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
______FeS2+______ O2 ______SO2+______Fe2O3
O2 ______SO2+______Fe2O3
(2)写出生产过程中X__________ ,Y___________ (填化学式)。
(3)产生CuCl的化学方程式_______________________________________________。
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点。如此再重复二次测得数据如下:
(已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+ )
| 1 | 2 | 3 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
④数据处理:计算得CuCl的纯度为__________。(平行实验结果相差不能超过0.3%)
-
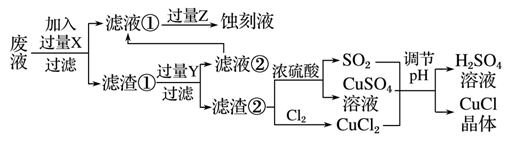
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X__________________,Y________________。
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________;生产过程中调节溶液的pH不能过大的原因是________________。
(3)写出产生CuCl的化学方程式:______________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_____________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是______________、氯碱工业的装置是_____________________。
(2)写出生产过程中X__________ Y___________ (填化学式)
(3)写出产生CuCl的化学方程式________________________________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是______________________________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是__________________________。
(6)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
_____________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ = Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业用如下流程,从酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。

请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式:_________________________。
(2)步骤②的操作名称是:_____________。
(3)步骤④中所加物质X为:__________。
(4)步骤⑤的操作是:___________________________________________________。
(5)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是:______________。
(6)在CuCl的生成过程中,可以循环利用的物质是______________,理论上_____(填“是”或“否”)需要补充(不考虑调节等消耗);理由是__________________________________。
(7)工业上还可以采用以碳棒为电极电解CuCl2溶液得到CuCl。写出电解CuCl2溶液中的阴极上发生的电极反应 ___________________________________________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸。工业上采用如下工艺流程,从某酸性废液(主要含Cu2+、Fe3+、 H+、Cl-)中制备氯化亚铜。

请回答下列问题:
(1)写出步骤①中发生的两个主要反应的离子方程式(2分): 。
(2)操作②的名称是: ,步骤④中所加物质X为: 。
(3)步骤⑥应调节溶液pH呈酸性,且用乙醇洗涤CuCl晶体,目的是: 。









