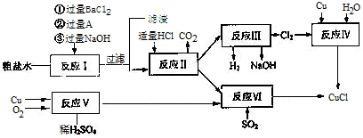-
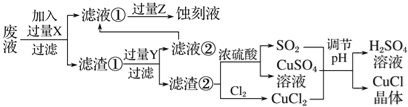
[化学——选修2化学与技术](15分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:

根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法名称是_____,现代氯碱工业的装置名称是_____________________。
(2)写出生产过程中X__________Y__________(填化学式)。
(3)写出产生CuCl的化学方程式________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_______________;生产过程中调节溶液的pH不能过大的原因是_____________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是______。
(6)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_______。
(7)工业氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ =Fe3+ + Ce3+ 如此再重复二次测得:
| 1 | 2 | 3 |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得该工业CuCl的纯度为_________(平行实验结果相差不能超过0.3%)
-
(14分)氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:
(1)工业生产硫酸的第一步反应如下,请配平该化学方程式并用单线桥法标注电子转移的方向和数目:
______FeS2+______ O2 ______SO2+______Fe2O3
O2 ______SO2+______Fe2O3
(2)写出生产过程中X__________ ,Y___________ (填化学式)。
(3)产生CuCl的化学方程式_______________________________________________。
(4)氯化亚铜的定量分析:
①称取样品0.25g 置于预先放入10mL过量的FeCl3溶液250mL的锥形瓶中,不断摇动;
②待样品溶解后,加水50mL,邻菲罗啉指示剂2滴;
③立即用0.10 mol•L-1硫酸铈Ce(SO4)2标准溶液滴至绿色出现为终点。如此再重复二次测得数据如下:
(已知:CuCl + FeCl3 ══CuCl2 + FeCl2 Fe2+ + Ce4+ ══ Fe3+ + Ce3+ )
| 1 | 2 | 3 |
| 0.25克样品消耗硫酸铈标准溶液的体积(mL) | 23.85 | 24.35 | 23.95 |
④数据处理:计算得CuCl的纯度为__________。(平行实验结果相差不能超过0.3%)
-
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)。Cu、稀硫酸,SO2等为原料合成CuCl的工艺如下:
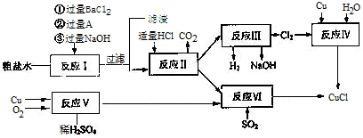
(1)反应I中加BaCl2溶液的作用是 ,步骤①②不能交换,原因是 。
(2)我国主要采用煅烧硫铁矿制取二氧化硫,其化学方程式为 ,将二氧化硫转变为三氧化硫的设备名称为 。
(3)反应V的化学方程式为 。
(4)反应VI的离子方程式为 。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是 。
(6)320g铜经反应V和反应VI制CuCl,若反应V中铜的转化率为90%,反应VI中硫酸铜的损失率为5%,可得到95%的CuCl的质量为 (保留小数点后两位)。
-
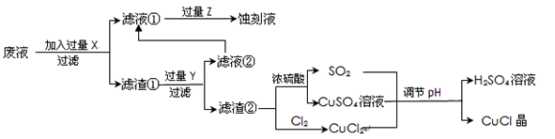
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色。下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:
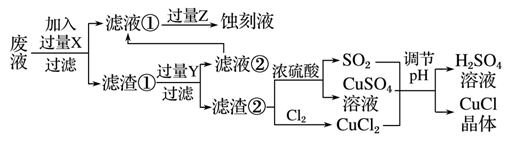
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X__________________,Y________________。
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是________________;生产过程中调节溶液的pH不能过大的原因是________________。
(3)写出产生CuCl的化学方程式:______________________。
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是_____________。
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程:
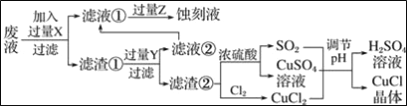
根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X_______,Y________
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是_________________;生产过程中调节溶液的pH不能过大的原因是__
(3)写出产生CuCl的化学方程式:__________________________________
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是________________________
-
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色;下图是工业上以制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程如下:


根据以上信息回答下列问题:
(1)该生产过程还可以与氯碱工业、硫酸工业生产相结合,工业生产硫酸的方法是______________、氯碱工业的装置是_____________________。
(2)写出生产过程中X__________ Y___________ (填化学式)
(3)写出产生CuCl的化学方程式________________________________________________________。
(4)生产中为了提高CuCl产品的质量,采用______________法快速过滤,析出的CuCl晶体不用水而用无水乙醇洗涤的目的是______________________________;生产过程中调节溶液的pH不能过大的原因是______________________________。
(5)在CuCl的生成过程中理论上不需要补充SO2气体,其理由是__________________________。
(6)在CuCl的生成过程中除环境问题、安全问题外,你认为还应该注意的关键问题是:
_____________________________________。
(7)氯化亚铜的定量分析:
①称取样品0.25g(称准至0.0002g)置于预先放入玻璃珠50粒和10ml过量的FeCl3溶液250ml锥形瓶中,不断摇动;玻璃珠的作用是____________________________。
②待样品溶解后,加水50ml,邻菲罗啉指示剂2滴;
③立即用0.10 mol·L-1硫酸铈标准溶液滴至绿色出现为终点;同时做空白试验一次。已知:CuCl + FeCl3 =CuCl2 + FeCl2 Fe2+ + Ce4+ = Fe3+ + Ce3+
如此再重复二次测得:
| 1 | 2 | 3 |
| 空白实验消耗硫酸铈标准溶液的体积(ml) | 0.75 | 0.50 | 0.80 |
| 0.25克样品消耗硫酸铈标准溶液的体积(ml) | 24.65 | 24.75 | 24.70 |
④数据处理:计算得CuCl的纯度为____________。(平行实验结果相差不能超过0.3%)
-
(10分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
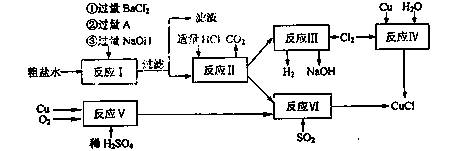
(1)A的化学式为________。
(2)写出反应V的化学方程式________。
(3)写出反应VI的离子方程式为________。
(4)本工艺中可以循环利用的物质是(刚化学式表示)________。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是________。
-
氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422
℃,沸点1366 ℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42—等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺流程如下:
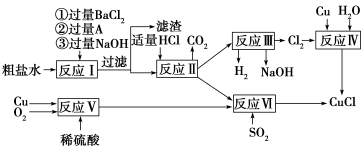
(1)A的化学式为________。
(2)写出反应Ⅴ的化学方程式______________________________________
(3)写出反应Ⅵ的离子方程式______________________________________
(4)本工艺中可以循环利用的物质是(用化学式表示)___________________________
(5)反应Ⅵ后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70 ℃ 燥2小时,冷却,密封包装即得产品。于70 ℃真空干燥的目的是_________________________
-
(12分)氯化亚铜(CuCl)是白色粉末,不溶于水、乙醇及稀硫酸,熔点422℃,沸点1366℃,在空气中迅速被氧化成绿色,常用作有机合成工业中的催化剂。以粗盐水(含Ca2+、Mg2+、SO42-等杂质)、Cu、稀硫酸、SO2等为原料合成CuCl的工艺如下:
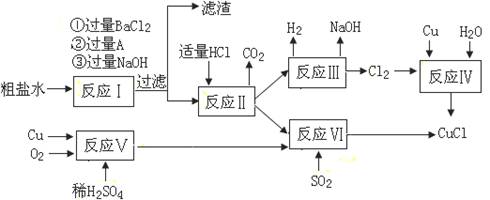
(1)A的化学式为________。
(2)写出反应V的化学方程式________。
(3)写出反应VI的离子方程式为________。
(4)本工艺中可以循环利用的物质是(用化学式表示)________。
(5)反应VI后,过滤得到CuCl沉淀,用无水乙醇洗涤沉淀,在真空干燥机内于70℃干燥2小时,冷却,密封包装即得产品。于70℃真空干燥的目的是________ 、________。
-
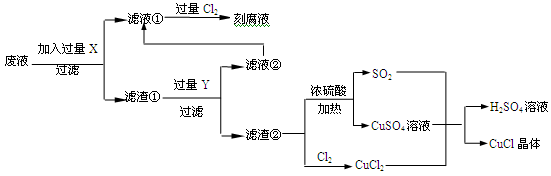
氯化亚铜(CuCl)常用作有机合成工业中的催化剂,是一种白色粉末;微溶于水、不溶于乙醇及稀硫酸;在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上以制作印刷电路板的废液(含Fe3+、Cu2+、Fe2+、Cl﹣)生产CuCl的流程:

根据以上信息回答下列问题:
(1)写出生产过程中所加试剂:X ,Y .
(2)生产中为了提高CuCl产品的质量,采用抽滤法快速过滤,析出的CuCl晶体不用水而用无水乙醇 洗涤的目的是 ;生产过程中调节溶液的pH不能过大的原因是 ;
洗涤的目的是 ;生产过程中调节溶液的pH不能过大的原因是 ;
(3)写出产生CuCl的化学方程式: .
(4)在CuCl的生成过程中除环境问题、安全问题外,还应该注意的关键问题是 .