-
高中化学《化学反应原理》选修模块从不同的视角对化学反应进行了探究、分析。以下观点中不正确的是
( )
①放热反应在常温下均能自发进行;
②电解过程中,化学能转化为电能而“储存”起来;
③原电池工作时所发生的反应一定有氧化还原反应;
④加热时,化学反应只向吸热反应 方向进行;
⑤盐类均能发生水解反应; ⑥化学平衡常数的表达式与化学反应方程式的书写无关。
A.①②④⑤ B.①④⑤⑥ C.②③⑤⑥ D.①②④⑤⑥
难度: 简单查看答案及解析
-
下列关于热化学反应的描述中正确的是( )
A.热化学方程式中化学计量系数可表示分子个数
B.稀HCl和NaOH稀溶液反应的中和热ΔH=-57.3 kJ/mol,则稀H2SO4和NaOH稀溶液反应的中和热ΔH=2×(-57.3) kJ/mol
C.1 mol甲烷燃烧生成二氧化碳和水蒸气所放出的热量是甲烷的燃烧热
D.碳与二氧化碳反应既是吸热反应,又是化合反应
难度: 简单查看答案及解析
-
断裂下列化学键需要吸收的能量分别为:H-H:436 kJ/mol;Br-Br:200kJ/mol;H-Br:369kJ/mol。下列说法正确的是( )
A.H2与Br2反应的热化学方程式为:H2(g)+Br2(g)===2HBr(g) ΔH=-102kJ
B.2 L HBr(g)分解成1 L H2(g)和1 L Br2(g)吸收102 kJ的热量
C.1 mol H2(g)与1 mol Br2(l)反应生成2 mol HBr(g)放出的热量大于102 kJ
D.在相同条件下,1 mol H2(g)与1 mol Br2(g)的能量总和大于2 mol HBr(g)的能量
难度: 简单查看答案及解析
-
关于反应:①2C2H2(g)+5O2(g)==4CO2(g)+2H2O(l);ΔH=-2600kJ/mol
②2CO(g)+O2(g)
2CO2(g);△H=-566kJ/mol
③CH4(g)+H2O(g)
CO(g)+3H2(g);ΔH=+216 kJ/mol。下列叙述正确的是( )
A.CO的燃烧热为-566kJ/mol
B.在③反应时,若加入催化剂,可以使ΔH减小
C.若有3.2g CH4与足量水蒸气按③反应,则放出热量是43.2 kJ
D.若生成相同质量的CO2,则放出的热量C2H2大于CO
难度: 简单查看答案及解析
-
已知:C(s)+CO2(g)
2CO(g) △H>0。反应达到平衡后,下列条件有利于反应向正方向进行的是 ( )
A. 升高温度和减小压强
B. 降低温度、减小压强和加催化剂
C. 降低温度和增大压强
D. 升高温度和增大压强
难度: 简单查看答案及解析
-
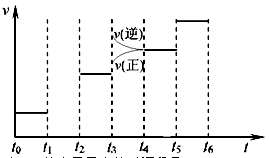
右图表示反应X(g)
4Y g)+Z g);△H<0, 在某温度时X的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )
A.第6min后,反应就终止了 B.若降低温度,v正和v逆将以同样倍数减小
C.X的平衡分解率为85%
D.若升高温度,X的平衡分解率将大于85%
难度: 简单查看答案及解析
-
在两个恒容容器中有平衡体系:①N2O4(g)
2NO2(g);②PCl5(g)
PCl3(g)+Cl2(g),X1和X2分别是N2O4和PCl5的分解率。在温度不变时,分别增加相同的物质的量的N2O4和PCl5,下列判断正确的是 ( )
A. X1降低,X2增大 B. X1、X2均降低 C. X1增大,X2降低 D. X1、X2均增大
难度: 简单查看答案及解析
-
对于可逆反应2AB3(g)
A2(g)+3B2(g);ΔH>0 (图中AB3%为体系中AB3的体积百分含量,v为反应速率)。关于该可逆反应的下列图象不正确的是

难度: 简单查看答案及解析
-
醋酸溶液中存在电离平衡:CH3COOH
H++CH3COO-,下列叙述不正确的是( )
A.醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D.常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
难度: 简单查看答案及解析
-
t℃时,水的离子积为Kw。在该温度下,混合可溶性的一元酸HA和一元碱BOH的溶液,下列有关混合液的各种关系中,可确认混合液呈中性的是( )
A.C(OH-)= B.C(A-)>C(B+) C.pH=7 D.C(H+)-C(OH-)=C(A-)-C(B+)
难度: 简单查看答案及解析
-
下列说法中可能正确的是( )
A.同温度同物质的量浓度时,HF比HCN易电离,则NaF溶液的pH比NaCN溶液大
B.物质的量浓度相等的H2S和NaHS混合溶液中:c(Na+)+c(H+)=c(HS
)+c(S
)+c(OH
)
C.25°C时,Mg(OH)2固体在20ml0.01 mol·L-1氨水中的Ksp比在20mL0.01mol·L-1NH4Cl
溶液中的Ksp小
D.AgCl悬浊液中加入K2S溶液,白色沉淀变成黑色,证明Ag2S比AgCl更难溶
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.物质的量浓度相同的NH4Cl和NH4HSO4两种溶液中,c(NH)前者小于后者
B. Al3+、NO3-、Cl-、CO32-、Na+可大量共存于pH=2的溶液中
C.分别与等物质的量的HCl和H2SO4反应时,消耗NaOH的物质的量相同
D.乙醇和乙酸都能溶于水,都是电解质
难度: 简单查看答案及解析
-
如下图所示,将两烧杯中电极用导线相连,四个电极分别为Mg、Al、Pt、C。当闭合开关S后,以下表述正确的是( )
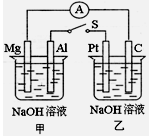
A.电流表指针不发生偏转
B.Al、Pt两极有H2产生
C.甲池pH减小,乙池pH不变
D.Mg、C两极生成的气体可以恰好完全反应
难度: 简单查看答案及解析
-
为研究金属腐蚀的条件和速率,某课外小组学生用铜丝将三根大小相同的铁钉分别固定在图示的三个装置中,再放置于玻璃钟罩里保存一周后,下列对实验结束时现象描述不正确的是( )
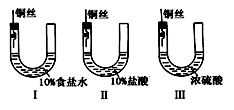
A.装置Ⅰ左侧的液面一定会上升
B.左侧液面装置Ⅰ比装置Ⅱ的低
C.装置Ⅱ中的铁钉腐蚀最严重
D.装置Ⅲ中的铁钉几乎没被腐蚀
难度: 简单查看答案及解析
-
如图电解池中装有硫酸铜溶液,选用不同材料的电极进行电解。下列说法正确的是( )

难度: 简单查看答案及解析
-
用惰性电极电解一定量的Cu(NO3)2溶液,下列说法中,正确的是 ( )
A.阳极发生的电极反应为:Cu2++2e-=Cu
B.阴极发生的电极反应为:4OH-=2H2O+O2↑+4e―
C.若有6.4 g金属Cu析出,放出的O2一定为0.05 mol
D.电解完成后,加入一定量的Cu(OH)2,溶液可能恢复到原来的浓度
难度: 简单查看答案及解析