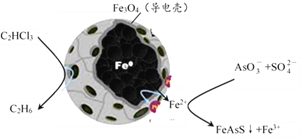
-
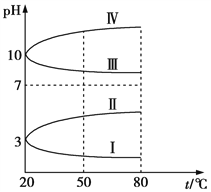
氯碱工业的基本原理就是电解饱和食盐水.下列关于实验室电解饱和食盐水的说法中正确的说法是( )
A. 可以选用碳棒作为阴、阳极材料,但阳极材料也可以用铁棒
B. 用湿润的淀粉KI试纸靠近阴极区域,试纸变蓝
C. 电解过程中,在阴极区域溶液中滴加酚酞,溶液变红色
D. 实验结束后将溶液搅拌,然后用pH试纸检验,溶液呈中性
难度: 中等查看答案及解析
-
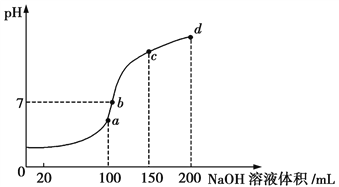
常温下,将甲酸和氢氧化钠溶液混合,所得溶液pH=7,则此溶液中( )
A. c(HCOO-)>c(Na+) B. c(HCOO-)<c(Na+)
C. c(HCOO-)=c(Na+) D. 无法确定c(HCOO-)与c(Na+)的关系
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A. 氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH-
B. 铅蓄电池充电时,标示“+”的接线柱连电源的正极,电极反应式为:PbSO4(S) - 2e-+2H2O(l)═PbO2(S)+4H+(aq)+SO42-(aq)
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-═Cu2+
D. 钢铁发生电化学腐蚀的正极反应式:Fe-2e-═Fe2+
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A. 能级就是电子层
B. 每个能层最多可容纳的电子数是2n2
C. 同一能层中的不同能级的能量高低相同
D. 不同能层中的s能级的能量高低相同
难度: 中等查看答案及解析
-
下列各基态原子的电子排布式正确的是( )
①Be:1s22s12p1 ②O:1s22s22p4
③He:1s12s1 ④Cl:1s22s22p63s23p5
A. ①② B. ②③
C. ①③ D. ②④
难度: 中等查看答案及解析
-
基态硅原子的最外能层的各能级中,电子排布的方式正确的是( )
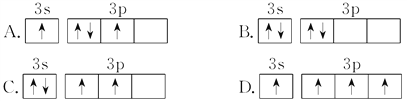
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
随着人们生活质量的提高,废电池必须集中处理的问题被提上议事日程,其首要原因是( )
A. 利用电池外壳的金属材料
B. 防止电池中汞、镉、铅等重金属离子对土壤和水源的污染
C. 回收其中的石墨电极
D. 不使电池中渗出的电解液腐蚀其他物品
难度: 中等查看答案及解析
-
下列应用与盐类的水解无关的是( )
A.纯碱溶液可去除油污
B.NaCl可用作防腐剂和调味剂
C.TiCl4溶于大量水加热制备TiO2
D.FeCl3饱和溶液滴入沸水中制Fe(OH)3胶体
难度: 中等查看答案及解析
-
下列事实不能说明CH3COOH为弱酸的是( )
A. 测得0.10mol/LCH3COOH溶液中存在较多的CH3COOH分子
B. 比较等浓度等体积盐酸、CH3COOH溶液与足量Zn反应生成H2的体积
C. 比较等浓度等体积盐酸、CH3COOH溶液与等量NaOH溶液反应后放出的热量
D. 0.10mol/LNH4Cl呈酸性,0.1mol/LCH3COONH4溶液呈中性
难度: 中等查看答案及解析
-
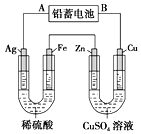
如图是模拟铁的电化学防护装置,不正确的叙述是( )

A. 此装置属于原电池
B. 此装置中电子从铁经导线流向锌
C. 此装置中的铁极上发生还原反应
D. 该电化学防护法称为“牺牲阳极阴极保护法”
难度: 中等查看答案及解析
-
下列选项中的数值前者小于后者的是( )
A. 25℃和l00℃时H2O的KW
B. 同温同浓度的KHCO3溶液和NH4HCO3,溶液中的c(HCO3-)
C. 同温同浓度的NaHCO3溶液和CH3COONa溶液的pH
D. 中和25mL0.1mol/L NaOH溶液所需CH3COOH和HCl的物质的量
难度: 困难查看答案及解析
-
物质的量浓度相同的下列溶液中,NH
浓度最大的是( )
A. NH4Cl B. NH4HSO4
C. CH3COONH4 D. (NH4)2Fe(SO4)2
难度: 简单查看答案及解析
-
欲使0.1mol/L的NaHCO3溶液中c(H+)、c(CO32- )、c(HCO3¯)都减少,其方法是( )
A. 加入氢氧化钠固体 B. 加氯化钠固体
C. 通入二氧化碳气体 D. 加入饱和石灰水溶液
难度: 中等查看答案及解析
-
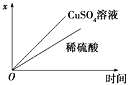
利用下图装置电解硫酸铜溶液,下列说法正确的是
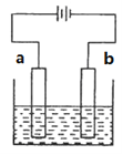
A.b电极上发生氧化反应
B.该装置能将化学能转变成电能
C.电解质溶液中Cu2+从b电极向a电极迁移
D.若a为铜,则a的电极反应式为:Cu-2e-=Cu2+
难度: 中等查看答案及解析
-
铜板上铁铆钉处的吸氧腐蚀原理如图所示,下列有关说法中,不正确的是( )
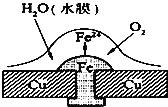
A. 此过程中还涉及到反应:4Fe(OH)2+2H2O+O2=4Fe(OH)3
B. 此过程中铜并不被腐蚀
C. 此过程中电子从Fe移向Cu
D. 正极电极反应式为:2H++2e-=H2↑
难度: 中等查看答案及解析
-
下列有关0.10mol·L-1的NH4Cl溶液的叙述正确的是( )
A. c(H+)<c(OH-) B. c(NH4+)>c(Cl-)
C. c(NH4+)+c(H+)=c(Cl-)+c(OH-) D. c(NH4+)+c(Cl-)=0.10mol·L-1
难度: 简单查看答案及解析
-
下列说法中正确的是
A. 常温下,pH均等于4的硫酸溶液与醋酸溶液,两种溶液中c(SO42-)与c(CH3COO-)之比为1:2
B. 常温下,向pH=4.0的醋酸溶液中加入水稀释后,溶液中c(H+)和c(OH-)都将变小
C. 常温下,0.1mol/L NaHA溶液的PH=5,溶液:c(HA-)>c(H+)>c(H2A)>c(A2-)
D. 0.1mol·L-1的(NH4)2Fe(SO4)2溶液中:c(NH4+)=c(SO42-)>c(Fe2+)>c(H+)
难度: 中等查看答案及解析
-
今有两种正盐的稀溶液,分别是a mol·L-1 NaX溶液和b mol·L-1 NaY溶液,下列说法不正确的是
A.若a=b,pH(NaX)>pH(NaY),则相同浓度时,酸性HX>HY
B.若a=b,并测得c(X-)=c(Y-)+c(HY) ,则相同浓度时,酸性HX>HY
C.若a>b,测得c(X-)=c(Y-),则可推出溶液中c(HX)>c(HY),且相同浓度时,酸性HX<HY
D.若两溶液等体积混合,测得c(X-)+c(Y-)+c(HX)+c(HY)=0.1 mol·L-1 ,则可推出a+b=0.2 mol·L-1 (忽略两溶液混合时溶液体积的改变)
难度: 困难查看答案及解析
-
查处酒后驾驶采用的“便携式乙醇测量仪”以燃料电池为工作原理,在酸性环境中,理论上乙醇可以被完全氧化为CO2,但实际乙醇被氧化为X,其中一个电极的反应式为:CH3CH2OH-2e-→X+2H+。下列说法中正确的是
A.电池内部H+由正极向负极移动
B.另一极的电极反应式为:O2 + 4e- + 2H2O = 4OH-
C.乙醇在正极发生反应,电子经过外电路流向负极
D.电池总反应为:2CH3CH2OH+O2→2CH3CHO+2H2O
难度: 中等查看答案及解析
-
用铂电极电解下表中各组物质的稀溶液(如图)一段时间后,甲、乙两池中溶液的pH均碱小,且在①和④两极的电极产物的物质的量之比为1:2的是( )
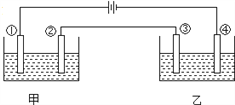
A
B
C
D
甲
KOH
H2SO4
Na2SO4
CuSO4
乙
CuSO4
AgNO3
HCl
HNO3
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
一定温度时,Cu2+、Mn2+、Fe2+、Zn2+等四种金属离子(M2+)形成硫化物沉淀所需S2-最低浓度的对数值lgc(S2-)与lgc(M2+)的关系如图所示。下列有关判断不正确的是 ( )
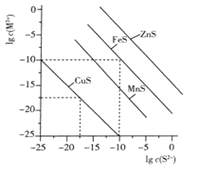
A. 该温度下,Ksp(MnS)大于1.0×10-35
B. 向含Mn2+、Zn2+的稀溶液中滴加Na2S溶液,Mn2+最有可能先沉淀
C. 向c(Fe2+)=0.1mol·L-1的溶液中加入CuS粉末,有FeS沉淀析出
D. 该温度下,溶解度:CuS>MnS>FeS>ZnS
难度: 困难查看答案及解析
-
下列有关溶液中粒子浓度关系的叙述正确的是( )
A. 0.1 mol·L−1 NH4NO3溶液中:c(
)>c(
)>c(H+)>c(OH−)
B. 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO−)=c(CO32−)+c(HCO3−)+c(H2CO3)
C. 向10 mL 0.2 mol·L−1 NaCl溶液中滴入2 mL 0.1 mol·L−1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(
)=c(Cl−)>c(Ag+)
D. 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO−)>c(OH−)>c(H+)
难度: 中等查看答案及解析
-
工业废气H2S经资源化利用后可回收能量并得到单质硫。反应原理为:2H2S(g)+O2(g)=S2(s)+2H2O(l) △H=-632kJ·mol-1。H2S燃料电池的工作原理如图所示。下列说法不正确的是( )
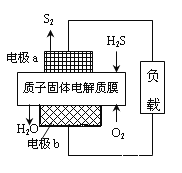
A. 电极a为电池的负极
B. 电极b上发生的电极反应为O2+4H++4e-=2H2O
C. 若电路中通过2mol电子,则电池内部释放632kJ热能
D. 若有17gH2S参与反应,则会有1molH+经质子膜进入正极区
难度: 困难查看答案及解析