-
中国古代记载文字的器物中,主要成分为蛋白质的是
A. 甲骨 B. 竹简 C. 青铜器 D. 丝帛
难度: 简单查看答案及解析
-
化学与生活密切相关,下列说法正确的是
A. 植树造林提高城市绿化覆盖率,属于绿色化学
B. 使用石灰修复酸化的土壤,可减少酸雨的发生
C. 用新能源汽车逐步取代燃油汽车,有利于环境保护
D. 将燃煤电厂、钢铁厂的烟囱造高,可减少污染物排放
难度: 简单查看答案及解析
-
下列说法正确的是
A. 乙烯和丁烷都能发生加成反应 B. 乙醇和乙酸都能与NaHCO3反应
C. 糖类和蛋白质都属于生物高分子 D. 油脂和乙酸乙酯都能发生水解反应
难度: 简单查看答案及解析
-
下列反应中,反应后固体物质质量不变的是
A. 在试管中加热小苏打粉末 B. 铝丝插入Cu(NO3)2溶液中
C. 在O2中灼烧Cu2S使之转化为CuO D. 水蒸气通过高温炽热的铁粉
难度: 简单查看答案及解析
-
下列实验操作能达到实验目的的是
A. 配制稀硫酸时,用10 mL量筒量取5.45 mL浓硫酸
B. 用稀硝酸清洗H2还原CuO后内壁附有Cu和Cu2O的试管
C. 将C与浓H2SO4反应产生的气体通入澄清石灰水检验CO2
D. 配制FeCl3溶液时,将FeCl3溶于热水中,冷却后加水稀释
难度: 简单查看答案及解析
-
NA为阿伏加德罗常数的值。下列说法正确的是
A. 3.8 g H37Cl和3H35Cl组成混合气体中含中子数为2NA
B. 22.4 L(标准状况)二溴乙烷中含有C-Br 键数为2NA
C. lmol Na 在0.5 molO2中燃烧至充分,转移电子数为2NA
D. 1L2 mol·L-l 氨水中加盐酸至中性时,生成NH4+数为2NA
难度: 简单查看答案及解析
-
下列对应关系正确的是
化学性质
实际应用
A
钠钾的合金具有强还原性
用于原子反应堆的导热剂
B
FeCl3能水解生成Fe(OH)3
用于脱除燃气中的H2S
C
MnO2其有催化作用
用作干电池正极的话性物质
D
N2H4常温下能与O2反应
用于脱除高压锅炉水中的O2
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W是周期表中所有元素原子半径最小的,W与Y、X与Z同主族,Z所在的族序数等于周期序数。下列说法错误的是
A. Y单质的熔点比Z单质的熔点高 B. Y、Z的简单离子的电子层结构相同
C. 最高价氧化物对应水化物的酸性:X>Z D. 化合物YXW4具有较强的还原性
难度: 简单查看答案及解析
-
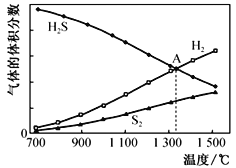
在其他条件相同时,反应N2+O2
2NO分别在有、无催化剂时的能量变化与反应进程如下图所示:下列说法中正确的是
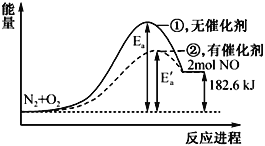
A. 该反应为放热反应
B. 加入催化剂可以改变反应的焓变
C. 加入催化剂可以改变反应的活化能
D. 0.1mol N2和0.1molO2充分反应吸热18.26 kJ
难度: 简单查看答案及解析
-
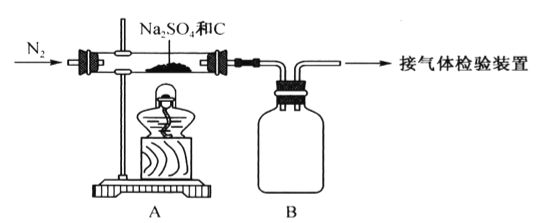
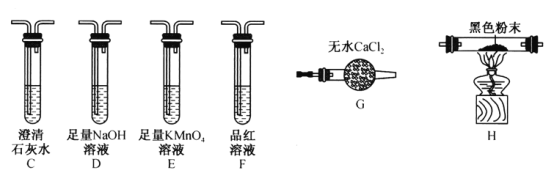
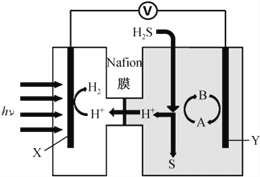
由SO2和O2制备SO3(熔点16.8℃,沸点44.8℃)的模拟装置如下图所示)(加热和夹持装置省略):
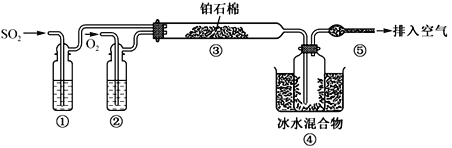
下列说法正确的是
A. 装置①中的试剂为饱和NaHSO3溶液
B. 实验室可用铜与稀硫酸在加热条件下制取SO2
C. 裝置③反应管中的铂石棉用作反应的催化剂
D. 从装置⑤逸出的气体有过量的SO2和O2
难度: 中等查看答案及解析
-
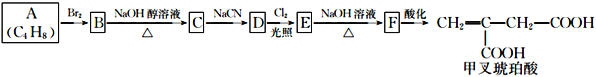
分子式均为C5H10O2的两种有机物的结构简式如右图所示:
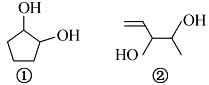
下列说法正确的是
A. 二者都能使Br2的CCl4溶液褪色
B. ①②分子中所有原子均可能处于同一平面
C. 等质量的①和②分别与足量钠反应生成等质量的H2
D. 与其互为同分异构体的酯有8种(不考虑立体异构)
难度: 简单查看答案及解析
-
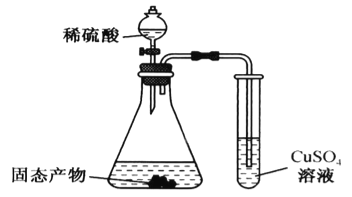
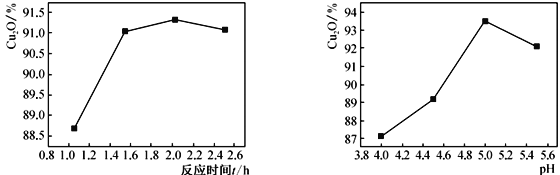
重铬酸钾(K2Cr2O7)具有强氧化性,是一种重要的化工原料,广泛应用于制革、印染、电镀等工业。以铬酸钾(K2CrO4)和氢氧化钾为原料,用电化学法制备重铬酸钾的实验装置如图所示。已知水溶液中存在平衡:2CrO42-+2H+
Cr2O72-+H2O。下列说法中正确的是
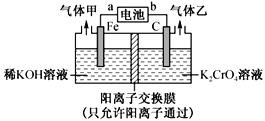
A. 气体甲和乙分别为O2和H2
B. 该装置中阴极区的pH减小
C. Fe电极反应式4OH--4e-=O2↑+2H2O
D. 当铬酸钾的转化率达到80%时,右池中
=
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是
实验
现象
结论
A
向KMnO4溶液中通入乙烯
溶液紫色逐渐褪去并有黑色沉淀
乙烯具有还原性
B
将红磷在燃烧匙中点燃,伸入集满N2O的集气瓶中
集气瓶中产生大量的白烟
N2O具有氧化性
C
向FeI2溶液中滴入少量氯水
溶液变黄色
还原性:I->Fe2+
D
分别向盛有少量ZnS和CuS的试管中加入3mL相同浓度盐酸
前者溶解,后者不溶
Ksp(ZnS)>Ksp(CuS)
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
常温时,分别改变相同物质的量浓度的H2CO3和氨水的pH,H2CO3、HCO3-、CO32-物质的量分数 (δ)及NH3·H2O、NH4+的物质的量分数(δ)如下图所示(不考虑溶液中的CO2和NH3分子):
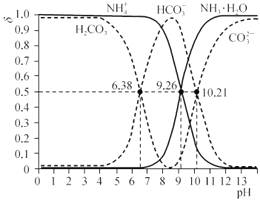
[已知δ=
、δ=
]
下列说法正确的是
A. NH4HCO3溶液显酸性
B. pH=5时,c(HCO3-)>c(H2CO3) >c(CO32-)
C. lgK1(H2CO3)=6.38
D. HCO3-+ NH3·H2O=NH4++CO32-+H2O的lgK=-0.95
难度: 中等查看答案及解析