-
下列装置或操作能达到实验目的是( )
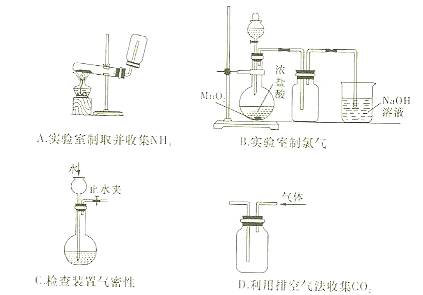
难度: 简单查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列叙述正确的是( )
A.2.8g铁粉在1.12L(标准状态)氯气中充分燃烧,失去的电子数为0.15NA
B.常温下,0.1mol/L HCl溶液中所含的H+个数为0.1NA
C.26.0g锌与一定量浓硫酸恰好完全反应,生成气体分子数为0.4NA
D.11.2L 的CO气体与0.5molN2所含的电子数相等
难度: 简单查看答案及解析
-
苯丙酸诺龙是一种兴奋剂,结构简式为:
有关该物质的说法正确的是
A.其分子式为C27H12O2 B.最多可与6mol H2发生加成反应
C.能使溴的四氯化碳溶液褪色 D.在NaOH溶液中水解后可生成两种盐
难度: 简单查看答案及解析
-
为提纯下列物质(括号中为杂质),所选除杂试剂和分离方法都正确的是( )
选项
被提纯的物质(杂质)
除杂试剂
分离方法
A
乙酸乙酯(乙酸)
饱和碳酸钠溶液
分液
B
NH3(H2O)
浓硫酸
洗气
C
KCl固体(I2)
KOH溶液
加热
D
苯(苯酚)
浓溴水
过滤
难度: 简单查看答案及解析
-
分子式为C2H11Cl的卤代烃,其分子中含有两个—CH3,两个—CH2—,一个
和一个—Cl,它可能的结构有( )
A.2种 B.3种 C.4种 D.5种
难度: 简单查看答案及解析
-
天津是我国研发和生产锂离子电池的重要基地。锂离子电池正极材料是含锂的二氧化钻(LiCoO2),充电时LiCoO2中Li被氧化,Li+迁移并以原子形式嵌入电池负极材料碳(C6)中,以LiC6表示。电池反应为LiCoO2+C6
CoO2+LiC6,下列说法正确的是 ( )
A.充电时,电池的负极反应为LiC6-e-
Li+C6
B.放电时,电池的正极反应为CoO2+Li++e-
LiCoO2
C.羧酸、醇等含活泼氢气的有机物可用作锂离子电池的电解质
D.锂离子电池的比能量(单位质量释放的能量)低
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定环境下能大量共存的是( )
A.pH=7的溶液中Al3+、Cl-、SO42-、HCO3-
B.由水电离出来的c(H+)=10-12mol/L的溶液中Na+、HCO3-、SO42-、K+
C.pH=0的溶液中Na+、K+、Fe2+、ClO
D.c(OH-)=10-2mol/L的溶液中S2-、SO32-、S2O32-、Na+
难度: 简单查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是
A.元素X、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X3Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY<XmR
D.元素Z的最高价氧化物对应的水化物是强碱
难度: 简单查看答案及解析
-
下列反应的离子方程式正确的是( )
A.NaHSO3溶液中滴加过量的Ba(OH)2溶液:
2HSO1—2OH-Ba2+
BaSO3↓+SO32-+2H2O
B.新制的硫酸亚铁溶液和过氧化氢溶液反应:Fe2++2H++H2O2
Fe3++2H2O
C.FeCl3溶液中滴加过量的氨水: Fe3++3NH2·H2O
Fe(OH)3↓+3NH4+
D.向100mL 3mol·L-1FeBr3溶液中通入标准状况下3.36L Cl2:
2Fe2++4Br-+3Cl2
2Fe3++2Br2+6Cl-
难度: 简单查看答案及解析
-
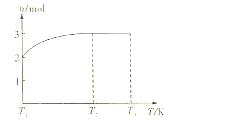
用纯净的CaCO3与100mL稀盐酸反应制取CO2,实验过程记录如图所示(CO2的体积已折算为标准状况下的体积)下列分析正确的是( )

A.OE段表示的平均速率最快
B.EF段,用盐酸表示该反应的平均反应速率为0.4mol/(L·min)
C.OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:6:7
D.F点表示收集到的CO2的量最多
难度: 简单查看答案及解析
-
100mL 0.1mol/L盐酸与50mL 0.2mol/L氨水混合,在所得溶液中,下列关系式正确的是( )
A.c(Cl-)>c(NH4+)>c(OH-)>c(H+)
B.c(Cl-)=c(NH4+)>c(OH-)=c(H+)
C.c(H+)+c(NH4+)=c(Cl-)
D.c(H+)+c(Cl-)=c(NH4+)+2c(NH3·H2O)+c(OH-)
难度: 简单查看答案及解析
-
关于下列装置说法正确的是( )

A.装置①中,盐桥中的K+移向ZnSO4溶液
B.装置②工作一段时间后,a极附近溶液的pH增大
C.用装置③精炼铜时,c极为粗铜
D.装置④中电子由Zn流向Fe,装置中有Fe2+生成
难度: 简单查看答案及解析
-
某含铬Cr2O72-废水用硫酸亚铁铵[FeSO4·(NH4)2SO4·6H2O]处理,反应中铁元素和铬元素完全转化为沉淀。该沉淀干燥后得到n mol FeO·FeyCrxO3。不考虑处理过程中的实际损耗,下列叙述错误的是( )
A.在FeO·FeyCrxO3中3x=y
B.处理废水中Cr2O72-的物质的量为
C.反应中发生转移的电子数为
D.消耗硫酸亚铁铵的物质的量为
难度: 简单查看答案及解析
-
将质量分数为5.2%的NaOH溶液1升(密度为1.06克/毫升)用铂电极电解,当溶液中的NaOH的质量分数改变了1.0%时停止电解,则此时溶液中应符合的关系是 ( )

难度: 简单查看答案及解析
-
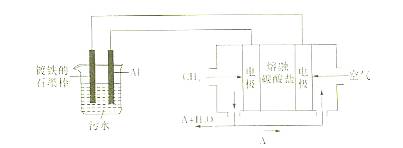
用惰性电极电解一定量的硫酸铜溶液,实验装置如图①。电解过程中的实验数据如图②,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况)。则下列说法正确的是( )
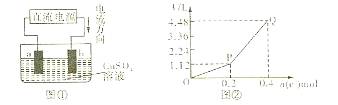
A.电解过程中,b电极表面先有红色物质析出,后有气泡产生
B.从开始到Q点时收集到的混合气体的平均摩尔质量为17g·mol-1
C.曲线OP段表示H2 和O2混合气体的体积变化,曲线PQ段表示O2的体积变化
D.a电极上发生的反应方程式为:
和
难度: 简单查看答案及解析
-
某溶液所含溶质是NaOH、Na2CO3、NaHCO3中的一种或两种。取两份等体积的该溶液,分别用酚酞和甲基橙作指示剂,用同浓度的盐酸滴定,当达到滴定终点时消耗盐酸的体积分别为V1和V2,若V1<V2<2V1,则上述溶液中的溶质是( )
A.Na2CO3 B.NaHCO3
C.NaOH和Na2CO3 D.Na2CO3和NaHCO3
难度: 简单查看答案及解析