-
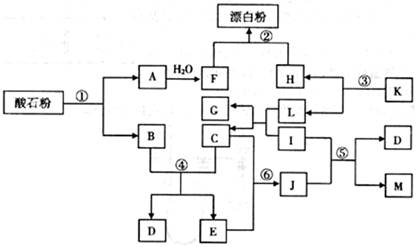
(14分)酸石粉主要成分为CaCO3。在下图各物质的相互转化中,K、I、J是日常生活中的调味剂,I、J、M、G为有机物,Mr(J)=60,Mr(M)=88,反应①②③均是工业生产中的重要反应。
请回答下列问题:
(1)K的化学式:,J的分子式:________。
(2)反应①中,含10g CaCO3的酸石粉,在 ℃、
℃、 kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为________。
kPa时,完全分解生成A(s)和B(g),吸引a kJ热量(杂质不反应),该反应的热化学方程式为________。
(3)反应④的化学平衡常数的表达式:K=________,已知 则该反应是________反应(填“吸热”或“放热”)。
则该反应是________反应(填“吸热”或“放热”)。
(4)反应⑤的化学方程式为________。
(5)反应⑥生成J,符合绿色化学原则的原因是________。
-
(14分)锌银电池比能量大、电压平稳,广泛用于电子手表、照相机、计算器和其他微型电子仪器。电解质溶液是KOH溶液,电池总反应为 。请回答下列问题:
。请回答下列问题:
(1)该电池的正极材料是________;电池工作时,阳离子向________(填“正极”或“负极”)移动;负极的反应式为________。
(2)①电极材料锌可由闪锌矿在空气中煅烧成氧化锌,然后用炭还原来制取,化学反应方程式为 ,此法为________;
,此法为________;
A.电解法 B.热还原法 C.热分解法
②电极材料氧化银可回收利用得到银,其化学方程式为。
(3)可用石墨为电极电解提纯氢氧化钾电解液。电解池内的阳离子交换膜只允许阳离子通过,其工作原理如图所示。

①该电解池的阴极反应式为________;
②除去杂质后的氢氧化钾溶液从出口________ (填“A”或“B”)导出;
③实验结束后,在相同条件下,a处与b处产生的气体体积比为________。
-
[化学—选修化学与技术] (15分)
H2O2的水溶液是一种常用的杀菌剂。
(1)H2O2旧的工业制法是以Pt为阳极、石墨为阴极电解硫酸氢铵溶液,再将电解产物水解。化学方程式为:
 。写出电解硫酸氢铵溶液的阴极和阳极反应工。
。写出电解硫酸氢铵溶液的阴极和阳极反应工。
阴极:________;
阳极:________;
(2)H2O2新的工业制法是先将乙基蒽醌加氢还原,再将中间产物去氢氧化即得H2O2,反应方程式为
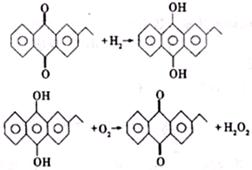
乙基蒽醌在此变化过程中的作用以及与旧的工业制法相比新工业制法的优点是________
________
。
(3)H2O2的实验室制法之一是将过氧化钡加入到稀硫酸中,该反应的化学方程式为________
________
(4)写出一种定量测定H2O2水溶液中H2O2含量的化学方程式
(5)写出符合(4)反应原理的简要实验步骤
________
________
________
-
[化学—选修物质结构与性质] (15分)
Q、R、X、Y、Z为周期表前四周期元素,原子序数依次递增。已知:
①Q为周期表中原子半径最小的元素;
②R的基态原子中电子占据三种能量不同的原子轨道,且每种轨道中的电子总数相同; ③Y的基态原子的核外成对电子数是未成对电子数的3倍;
④Q、R、Y三种元素组成的一种化合物M是新装修居室中常含有的一种有害气体,Q、R两种元素组成的原子个数比为1:1的化合物N是中学化学中常见的有机溶剂;
⑤Z有“生物金属”之称,Z4+离子和氩原子的核外电子排布相同。
请回答下列问题:(答题时,Q、R、X、Y、Z用所对应的元素符号表示)
(1)化合物M的空间构型为________,其中心原子采取________杂化;化合物N的固态时的晶体类型为________。
(2)R、X、Y三种元素的第一电离能由小到大的顺序为________。
(3)由上述一种或多种元素组成的与RY2互为等电子体的分子为________(写分子式)。
(4)由R、X、Y三种元素所组成的RXY 离子在酸性条件下可与NaClO反应,生成X2、RY2等物质。上述反应的离子方程式为________。
离子在酸性条件下可与NaClO反应,生成X2、RY2等物质。上述反应的离子方程式为________。
(5)Z原子基态时的外围电子排布式为________,Z的一种含氧酸钡盐的晶胞结构如右图所示,晶体内与每个“Z”原子等距离且最近的氧原子数为________。

-
[化学—选修有机化学基础] (15分)
中药莲花清瘟胶囊是治疗甲型H1N1流感的有效药物,连翘是其主要成分之一,芳香族化合物X是合成连翘的有效成分连翘酯苷的中间体。
已知:
①X的相对分子质量180,碳的质量分数为60%,氢为4.45%,其余为氧;
②1mol X最多能与3mol NaOH反应,且X能与NaHCO3反应产生CO2气体;
③X遇FeCl3发生显色反应;
④经红外光谱分析X分子中含有碳碳双键。
请回答下列问题:
(1)X的分子式为________,X中含有的官能团的结构简式为________。
(2)X可发生的反应有。
A.取代反应 B.加聚反应 C.水解反应 D.银镜反应 E.酯化反应
(3)X分子中苯环上两个相同的取代基相邻,与另一种取代基不相邻,核磁共振氢谱表明有8种氢原子,则其结构简式为________。
(4)X与足量的浓溴水反应的化学方程式为________。
(5)有机物Y与X互为同分异构体,请写出符合下列条件的Y结构简式________。
①Y的苯环上有三个互不相邻的取代基,遇FeCl3不发生显色反应,不与NaHCO3反应,但能与Na反应生成H2;
②1mol Y最多能与4mol Ag(NH3)2OH发生银镜反应;
③在一定条件下,1mol Y最多与2mol NaOH反应。
代表阿伏加德罗常数,下列叙述正确的是
个H2,一定生成
个O2
个电子
2和+4
在一定条件下达到平衡,下列说法正确的是