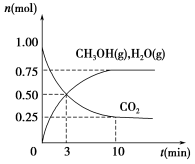
-
500 mL 1 mol/L的稀HCl与锌粒反应,不会使反应速率加快的是
A.升高温度
B.将500 mL 1 mol/L的HCl改为1000 mL 1 mol/L的HCl
C.用1 mol/L的H2SO4代替1 mol/L的HCl
D.用锌粉代替锌粒
难度: 中等查看答案及解析
-
分析下图中的能量变化情况,下列表示方法中正确的是

A.2A+B=2C ΔH<0
B.2C=2A+B ΔH<0
C.2A(g)+B(g)=2C(g) ΔH>0
D.2A(g)+B(g)=2C(g) ΔH<0
难度: 中等查看答案及解析
-
下列叙述正确的是
A.强电解质溶液的导电性不一定比弱电解质溶液的导电性强
B.常温下,将pH=3的醋酸溶液稀释到原体积的10倍后,溶液的pH=4
C.若测得雨水的pH小于7,则下的是酸雨
D.在通风橱中进行有毒气体实验符合“绿色化学”思想
难度: 简单查看答案及解析
-
下列说法正确的是
A.25℃时,向饱和AgCl水溶液中加入盐酸,Ksp值变小
B.25℃时,向CaCO3饱和溶液通入CO2,有沉淀生成
C.25℃时,向CaCl2溶液中通入SO2,有白色沉淀生成
D.25℃时,在Mg(OH)2的悬浊液中加入少量的NH4Cl固体,c(Mg2+)增大
难度: 中等查看答案及解析
-
下列物质的稀水溶液中,除水分子外,不存在其它分子的是
A.NH4Cl B.NaHSO3 C.HNO3 D.HClO
难度: 简单查看答案及解析
-
下列表述中,合理的是
A.把FeCl3的水溶液加热蒸干可得到FeCl3固体
B.用惰性电极电解足量的CuCl2溶液时,当有0.2 mol电子转移时阳极会析出6.4g铜
C.用25 mL碱式滴定管量取15.00mL 0.1000 mol·L-1酸性高锰酸钾溶液
D.将水加热,Kw增大,pH变小
难度: 中等查看答案及解析
-
在一定温度下,向一容积不变的密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应:
X(g) + 2Y(g)
2Z(g),此反应达到平衡的标志是
A.容器内压强不随时间变化
B.容器内气体密度不随时间变化
C.容器内X、Y、Z的浓度之比为l : 2 : 2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
难度: 中等查看答案及解析
-
将下图所示实验装置的 K 闭合,下列判断正确的是
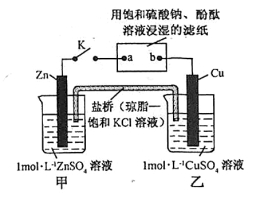
A.Cu 电极上发生氧化反应
B.电子沿 Cu→b→a→Zn路径流动
C.片刻后乙池中c(SO42-)增大
D.片刻后可观察到滤纸a点变红色
难度: 中等查看答案及解析
-
某无色溶液中粒子能大量共存,通入CO2后仍能大量共存的一组是
A.K+、SO42-、Br-、SiO32- B.H+、Fe2+、Cl- 、NH4+
C.Na+、Ba2+、NO3-、Cl- D.Na+、Ag+、NH3•H2O、NO3-
难度: 中等查看答案及解析
-
对于可逆反应A(g)+2B(g)
2C(g) △H>0,下列图象中正确的是
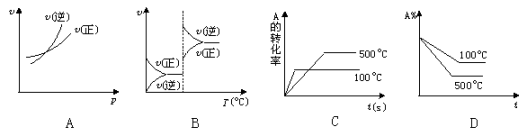
难度: 中等查看答案及解析
-
下列有关叙述正确的是

A.如图装置所示,可准确测定中和热
B.若用50mL 0.55mo1·L—1的氢氧化钠溶液,分别与50mL 0.50mo1·L—1的盐酸和 50mL0.50mo1·L—1的硫酸充分反应,两反应测定的中和热不相等
C.在中和滴定实验中,滴定管用蒸馏水洗涤后,再用标准液润洗,再加进标准液
D.进行中和滴定操作时,左手震荡锥形瓶,右手转动活塞控制液滴流速,眼睛要始 终注视滴定管内溶液液面的变化
难度: 中等查看答案及解析
-
常温下,1体积pH=2.5的盐酸与10体积某一元强碱溶液恰好完全反应,则该碱溶液的pH等于
A.9.0 B.9.5 C.10.5 D.11.5
难度: 中等查看答案及解析
-
在2mlNaCl溶液中加入1滴AgNO3溶液,有白色沉淀生成;再加入1滴KI溶液沉淀转化为黄色,然后再加入1滴Na2S溶液,沉淀又转化为黑色(以上所用的溶液物质的量浓度均相同),下列表示各沉淀物溶解度由大到小的顺序正确的是
A.Ag2S AgI AgCl B.AgCl AgI Ag2S
C.AgI AgCl Ag2S D.AgCl Ag2S AgI
难度: 简单查看答案及解析
-
已知相同条件下同浓度的NaCN与NaF的稀溶液,前者的pH值大于后者,相同条件下比较同浓度同体积两种溶液中的关系,其中正确的是
A.c(CN-)>c(F-) B.c(Na+)=c(CN-)=c(F-)
C.NaCN水解程度比NaF大 D.两者所含水分子总数相等
难度: 中等查看答案及解析
-
关于小苏打水溶液的表述正确的是
A.c(Na+) = c(HCO3-) + c(CO32-) + c(H2CO3)
B.c(Na+)+ c(H+) = c(HCO3-) + c(OH-) + c(CO32-)
C.HCO3-的电离程度大于HCO3-水解程度
D.存在的电离有NaHCO3 = Na+ + HCO3-、HCO3-
CO32- + H+、H2O
H+ + OH-
难度: 中等查看答案及解析
-
FeCl3水解平衡为:Fe3++3H2O
Fe(OH)3+3H+;若要使c(Fe3+)降低,且pH值增大的方法是
A.降低温度 B.通入少量HCl气体
C.加入少量Fe粉 D.加入适量蒸馏水
难度: 中等查看答案及解析
-
下图表示反应X(g)
4Y(g)+Z(g),△H<0,在某温度时X的浓度随时间变化的曲线:下列有关该反应的描述正确的是

A.X的平衡转化率为85%
B.第6 min 后,反应就终止了
C.第6 min 后,若降低温度,正速率增大,逆速率减少,平衡向正方向移动
D.若升高温度,X的平衡转化率将小于85%
难度: 中等查看答案及解析
-
在下列叙述中,能说明盐酸是强酸,醋酸是弱酸的是
A.将pH=4的盐酸和醋酸稀释成pH=5的溶液,盐酸加水后体积为原溶液的10倍,醋酸所需加入的水量比前者多
B.盐酸和醋酸都可用相应的钠盐与浓硫酸反应制取
C.相同pH的盐酸和醋酸溶液中分别加入相应的钠盐固体,醋酸的pH变大
D.pH值相同的盐酸和醋酸分别跟锌反应时,产生氢气的起始速率相等
难度: 中等查看答案及解析
-
已知H2S两级电离常数分别为K1=1.3×10—7,K2=7.1×10—15;CH3COOH的电离常数K=1.75×10—5,试根据上述数据,判断下列化学反应方程式正确的是
A.Na2S+2CH3COOH(足量)=2CH3COONa+H2S↑
B.Na2S+2CH3COOH(少量)=2CH3COONa+H2S↑
C.Na2S(少量)+CH3COOH=CH3COONa+NaHS
D.CH3COOH+NaHS=CH3COONa+H2S↑
难度: 简单查看答案及解析