-
下列分离物质的方法中,根据微粒大小进行分离的是 ( )
①分液 ②过滤 ③分馏 ④重结晶 ⑤渗析
A.②⑤ B.②④ C.①② D. ①③⑤
难度: 简单查看答案及解析
-
Na2O、NaOH、Na2CO3、NaCl、Na2SO4可按某种标准划为同一类物质,下列分类标准正确的是 ( )
①钠的化合物 ②能与硝酸反应的物质
③可溶于水的物质 ④电解质
⑤钠盐 ⑥钠的含氧化合物
A.①③④⑤ B.①②⑤⑥ C.①③④ D.②⑤⑥
难度: 简单查看答案及解析
-
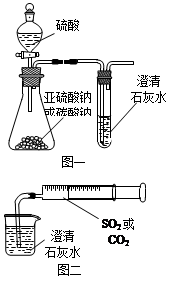
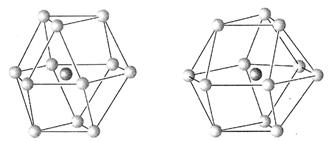
用示意图或图示的方法能够直观形象地将化学知识传授给学生,下列示意图或图示正确的是( )
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.根据是否有丁达尔现象将分散系分为:溶液、胶体、浊液。
B.双氧水、水玻璃、氯水都是混合物
C.强电解质的导电能力一定比弱电解质强
D.酸性氧化物一定是非金属氧化物
难度: 简单查看答案及解析
-
下列实验方法不能达到目的的是 ( )
A.用加热的方法分离氯化钠和氯化铵的固体混和物
B.用水鉴别乙醛、苯、硝基苯
C.用核磁共振氢谱鉴定未知物C2H6O的分子结构
D.用10mL量筒量取5.00mL1.00 mol·L-1盐酸配制0.100mol·L-1盐酸
难度: 简单查看答案及解析
-
NA表示阿伏加德罗常数,下列说法中正确的是 ( )
A.由2H和18O所组成的水11g,其中所含的中子数为4NA
B.1 mol FeCl3跟水完全反应转化为氢氧化铁胶体后,其中胶体粒子的数目为NA
C.2.3 g Na和足量的O2完全反应,在常温和燃烧时,转移电子数均为0.1NA
D.500mL0.1mol•L—1盐酸溶液中,含有HCl分子数目为0.25 NA
难度: 简单查看答案及解析
-
某中性含Na+的溶液中,可能还存在NH4+ 、Fe2+ 、Br- 、CO32- 、I- 、SO32-六种离子中的一种或几种。进行以下实验:①在原溶液中滴加足量氯水后,有气泡产生,溶液呈橙黄色;②向橙黄色溶液中加入BaCl2溶液时,无沉淀生成;③橙黄色溶液不能使淀粉变蓝。由此可以推知该溶液中肯定不存在的离子是 ( )
A.NH4+ 、Br- 、CO32- B.NH4+ 、I- 、SO32-
C.Fe2+ 、I- 、SO32- D.Fe2+ 、CO32- 、I-
难度: 简单查看答案及解析
-
在常温下,发生下列反应:①16H++10Z-+2XO4-→2X2++5Z2+8H2O;②2A2++B2→2A3++2B-;③2B-+Z2→B2+2Z-。根据上述反应,判断下列结论中错误的是 ( )
A.溶液中可发生:Z2+2A2+→2A3++2Z-
B.Z2在①、③反应中为还原剂
C.氧化性强弱的顺序为:XO4->Z2>B2>A3+
D.X2+是XO4-的还原产物
难度: 简单查看答案及解析
-
科学家成功合成出具有化学特性的氢铝化合物(AlH3)n,最简单的氢铝化合物是Al2H6,它的熔点为150℃,燃烧热极高。下列关于氢铝化合物的推测不正确的是 ( )
A.氢铝化合物与水反应生成氢氧化铝和氢气
B.氢铝化合物中铝显+3价,H显-1价
C.氢铝化合物中不可能存在AlnH2n+2(n为正整数)
D.氢铝化合物具有强还原性
难度: 简单查看答案及解析
-
向一定量的Fe、FeO、Fe2O3、Fe3O4的混合物中加入150mL4 mol·L-1的稀硝酸恰好使混合物完全溶解,放出2.24LNO(标准状况),往所得溶液中加入KSCN溶液,无红色出现。若用足量的H2在加热条件下还原相同质量的混合物,所得到的铁的物质的量为
( )
A.0.21mol B.0.25mol C.0.3mol D.0.35mol
难度: 简单查看答案及解析
-
取相同体积的KI、Na2S、FeBr2溶液,分别通入足量的Cl2,当反应恰好完成时,消耗Cl2的体积相同(同温、同压条件下),则KI、Na2S、FeBr2溶液的物质的量浓度之比是
( )
A.1:1:2 B.2:1:3 C.6:3:2 D.3:2:1
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是 ( )
A.碳酸钡溶于醋酸:BaCO3+2H+=Ba2++H2O+CO2↑
B.NaClO溶液与FeCl2溶液混合:Fe2+ + 2ClO- + 2H2O= Fe(OH)2↓ + 2HClO
C.NH4HSO3溶液与足量NaOH溶液反应:NH4+ + OH-= NH3↑ + H2O
D.将1mol/L NaAlO2溶液和1.5mol/L的HCl溶液等体积互相均匀混合:
6AlO2-+9H++3H2O=5Al(OH)3↓+Al3+
难度: 简单查看答案及解析
-
下列为某同学根据中学化学教材中数据所做的判断,其中错误的是 ( )
A.根据溶解度数据,判断长时间煮沸Mg(HCO3)2溶液所得的沉淀是MgCO3还是Mg(OH)2
B.根据沸点数据,判断能否用分馏的方法分离一些液体混合物
C.根据反应热数据,判断不同反应的反应速率的大小
D.根据晶格能的数据,判断离子晶体的稳定性
难度: 简单查看答案及解析
-
下列排列顺序正确的是 ( )
①热稳定性:H2O>HF>H2S ②原子半径:Na>Mg>O
③酸性:H3PO4>H2SO4>HClO4 ④结合质子(H+)能力:OH->CH3COO->Cl-
A.①③ B.②④ C.①④ D.②③
难度: 简单查看答案及解析
-
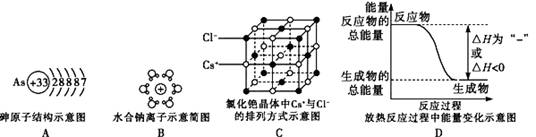
下列有关物质结构的叙述正确的是 ( )
A.只含有共价键的物质不一定是共价化合物
B.由电子定向移动而导电的物质是金属晶体
C.有键能很大的共价键存在的物质熔沸点一定很高
D.在离子化合物中不可能存在非极性共价键
难度: 简单查看答案及解析
-
下列说法正确的是 ( )
A.最外层有4个电子的原子都是非金属原子
B.同一主族的两种元素的原子序数之差不可能是44
C.COCl2分子和CCl4分子中所有原子都满足最外层8电子结构
D.同主族金属的原子半径越大熔点越高
难度: 简单查看答案及解析
-
将氯水分别滴入下列各选项所述的溶液中,由实验现象得出的结论完全正确的是( )
选项
氯水滴入下列溶液中
实验现象
结论
A
滴有KSCN的FeCl2溶液
变红
Cl2具有还原性
B
滴有酚酞的NaOH溶液
褪色
Cl2具有酸性
C
紫色石蕊溶液
先变红后褪色
Cl2具有漂白性
D
KI淀粉溶液
变蓝色
Cl2具有氧化性
难度: 简单查看答案及解析
-
根据下列实验事实,得出的结论正确的是 ( )
A.气体 品红溶液褪色
结论:原气体一定是SO2
B.气体A 气体B 白色沉淀
结论:原气体一定是烃
C.某溶液 冒白雾 白烟
结论:原溶液一定是浓盐酸
D.某溶液 血红色
结论:原溶液中一定含有Fe3+
难度: 简单查看答案及解析
-
下面是两种兴奋剂的结构简式:
兴奋剂X 兴奋剂Y
关于它们的说法中正确的是 ( )
A.1mol X与足量的NaOH溶液在常温常压下反应,最多消耗3mol NaOH
B.1mol X与足量的氢气反应,最多消耗2mol H2
C.Y与足量的浓溴水反应,能产生白色沉淀
D.Y遇到FeCl3溶液时显紫色,但不能使溴的四氯化碳溶液褪色
难度: 简单查看答案及解析
-
X、Y、Z、W均为中学化学的常见物质,一定条件下它们之间有如下转化关系(其它产物已略去):下列说法不正确的是( )
A.若W是单质铁,则Z溶液可能是FeCl2溶液
B.若W是氢氧化钠,则X与Z可反应生成Y
C.若X是金属镁,则W可能是强氧化性的单质
D.若X为甲醇,则X、Z的相对分子质量可能相差14
难度: 简单查看答案及解析
-
根据已学知识推断下列数据可信的是 ......... ( )
A.某元素的原子半径是0.160nm B.某常见气体的密度为1.8g/cm3
C.某硫酸钙溶液的浓度是2.0mol/L D.某溶液中溶质的质量分数超过100%
难度: 简单查看答案及解析
-
下列说法中正确的是 ( )
A.天然气、液化气和氢气分别属于化石能源、可再生能源和新能源
B.蔗糖、硫酸钡和水分别属于非电解质、强电解质和弱电解质
C.光导纤维、集成电路晶体管,分别属于硅和二氧化硅的用途之一
D.碳酸钠、氢氧化钠、碳酸氢钠的俗名分别为苏打、纯碱、小苏打
难度: 简单查看答案及解析
-
现有200mL MgCl2和AlCl3的混合溶液,其中c(Mg2+)=0.2mol/L,c(Cl-)=1.3mol/L,要使Mg2+转化成Mg(OH)2,并使Mg2+、Al3+分离开来,4mol/L NaOH溶液的最少用量为 ( )
A.140mL B.120mL C.11mL D.80mL
难度: 简单查看答案及解析
-
分子式为C9H6O3(只有苯环而不含其它的环)的有机物在苯环上的一氯取代物只有一种的结构种类为 ( )
A.2种 B.3种 C.4种 D.5种
难度: 简单查看答案及解析
-
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素X。它们有如下的转化关系:A在碱性条件下反应生成B、C,B、C在酸性条件下生成A。(部分产物及反应条件已略去):下列判断正确的是 ( )
A.反应①和②一定为氧化还原反应 B.X元素不一定为非金属元素
C.反应①和②互为可逆反应 D.X元素可能为Al
难度: 简单查看答案及解析