-
化学与生产、生活密切相关。下列说法正确的是
A.光导纤维的主要成分是单质硅
B.新型氢动力汽车的使用可减少雾霾的产生
C.明矾可用于自来水消毒
D.福尔马林可用于食品保鲜
难度: 简单查看答案及解析
-
下列对物质的结构组成表示恰当的是
A.H2O2的结构式:H—O—H—O
B.硫离子的结构示意图:
C.二氧化碳的比例模型:

D.氧化铁的化学式: FeO
难度: 简单查看答案及解析
-
下列物质中具有良好导电性的是
A.冰醋酸 B.盐酸 C.KCl晶体 D.蔗糖溶液
难度: 简单查看答案及解析
-
下列各物质分别滴加浓硫酸后,现象描述正确的是
A.胆矾晶体由蓝色变无色 B.pH试纸变红
C.蓝色石蕊试液褪色 D.白纸变黑
难度: 简单查看答案及解析
-
下列关于金属腐蚀的叙述不正确的是
A.黄铜(铜锌合金)制作的铜锣不易产生铜绿
B.与生铁相比纯铁更容易被腐蚀
C.金属的吸氧腐蚀和析氢腐蚀都属于电化学腐蚀
D.金属腐蚀的本质是M - ne‑ = Mn+
难度: 简单查看答案及解析
-
下列有关氮及其化合物的说法不正确的是
A.硝酸应保存在棕色试剂瓶里
B.铵态氮肥不宜与碱性肥料混合施用
C.常温下铁、铝不与浓硝酸反应
D.NO可用排水法收集,NO2可用向上排空气法收集
难度: 简单查看答案及解析
-
下列关于有机物的叙述不正确的是
A.乙烯和苯都能使溴水褪色
B.乙醇和二甲醚(CH3OCH3)互称为同分异构体
C.石油的分馏属于物理变化
D.纤维素、油脂、蛋白质三种高分子化合物均能水解
难度: 简单查看答案及解析
-
以下方法可用于工业冶炼金属的是
A.电解熔融AlCl3获取金属铝 B.电解MgCl2溶液获取金属镁
C.用CO还原铁矿石来获取金属铁 D. 电解饱和食盐水来获取金属钠
难度: 中等查看答案及解析
-
共价键、离子键和分子间作用力是构成物质的微粒间的不同作用方式,下列物质中只存在上述一种作用方式的是
A.二氧化碳 B.氢氧化钠固体 C.NaCl晶体 D.氯气
难度: 中等查看答案及解析
-
常温时能与水反应产生H2的是
A.Na B.NH4Cl C.Na2O2 D.NO2
难度: 简单查看答案及解析
-
碘元素的一种
核素 可用于治疗肿瘤。下列有关碘元素的说法正确的是
A.
核外有72个电子 B.
与
互为同素异形体
C.
能使淀粉溶液变蓝 D.
最外层电子数为7
难度: 简单查看答案及解析
-
以下分离提纯操作能达到相应目的的是
选项
操作
目的
A
电解精炼
将粗铜转化为精铜
B
蒸馏
分离氯化钠和硝酸钾混合溶液
C
分液
分离乙酸与乙酸乙酯混合物
D
用乙醇作萃取剂
提取溴水中的溴单质
难度: 简单查看答案及解析
-
化学反应伴随能量变化,下列说法中错误的是
A.TNT(炸药)爆炸时部分化学能转化为热能
B.电解饱和食盐水时部分化学能转化为电能
C.镁条燃烧时部分化学能转化为光能
D.植物光合作用时部分光能转化为化学能
难度: 简单查看答案及解析
-
下列离子方程式正确的是
A.醋酸溶解鸡蛋壳:2H++ CO32-== CO2↑+ H2O
B.铝片加入烧碱溶液:2A1+ 2OH—+ 2H2O== 2A1O2—+ 3H2↑
C.铁与盐酸反应:2Fe + 6H+== 2Fe3+ + 3H2↑
D.铜片投入FeCl3溶液中:Cu+ Fe3+== Cu2+ + Fe2+
难度: 中等查看答案及解析
-
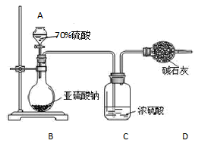
H2S2O3是一种弱酸,实验室欲用0.01 mol·L-1的Na2S2O3溶液滴定I2溶液,发生的反应为I2+2Na2S2O3 =2NaI+Na2S4O6,下列说法合理的是

A.该滴定可用甲基橙做指示剂
B.Na2S2O3是该反应的还原剂
C.该滴定可选用右图所示装置
D.该反应中每消耗2mol Na2S2O3,电子转移数为4mol
难度: 中等查看答案及解析
-
NA为阿伏加德罗常数,下列叙述正确的是
A.1L 0.5mol·L-1氨水中所含NH4+数为0.5NA
B.1mol Fe与足量氯气反应转移的电子数为2 NA
C.标准状况下,33.6L CO2约含有1.5NA个分子
D.1 mol
中含碳碳双键数为3 NA
难度: 中等查看答案及解析
-
第三周期元素X、Y、Z可分别形成Xn+、Ym+、Zn-三种离子,已知m>n,且三种元素相应的最高价氧化物对应水化物两两之间会发生反应。下列说法中不正确的是
A.Y为Al
B.Z的最高价氧化物对应水化物的分子式为HClO4
C.X与Z结合形成离子化合物
D.X、Y、Z原子半径Z>X>Y
难度: 中等查看答案及解析
-
运用盖斯定律可方便地计算出难以通过实验直接测定的反应热。已知:
①P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ·mol-1
②P(红磷,s)+
O2(g)=
P4O10(s) ΔH=-738.5kJ·mol-1
则白磷转化为红磷的热化学方程式为
A.P4(白磷,s)=4P(红磷,s) △H=-29.2kJ·mol-1
B.P4(白磷,s)=4P(红磷,s) △H=+29.2kJ·mol-1
C.P4(白磷,s)=4P(红磷,s) △H=-2244.7kJ·mol-1
D.P4(白磷,s)=4P(红磷,s) △H=+2244.7kJ·mol-1
难度: 简单查看答案及解析
-
下列有关实验现象或操作预测的叙述正确的是

A.Ⅰ可用于分离乙醇和水
B.Ⅱ说明该装置气密性良好
C.Ⅲ该装置可用于制取并收集乙酸乙酯
D.Ⅳ由a进气可用于收集NH3
难度: 简单查看答案及解析
-
下列根据化学事实进行的相关推论,正确的是
化学事实
推论
A
将SO2通入品红溶液中,溶液褪色
SO2具有氧化性
B
铝热反应需要高温引燃
该反应的ΔH>0
C
聚光束仪照射淀粉溶液,看到一条“光亮通路”
淀粉分子直径>10-7m
D
向溶液中滴加KSCN,无明显现象,再加氯水,看到溶液变为血红色
说明原溶液中含有Fe2+
难度: 中等查看答案及解析
-
根据水溶液中存在的平衡关系,判断下列说法正确的是
A.往水中滴加少量稀硫酸,能促进水电离
B.室温下,稀释0.1mol·L-1的醋酸,溶液中所有离子的浓度均降低
C.往AgCl悬浊液中加入0.1mol·L-1Na2S溶液,有黑色沉淀产生
D.浓度均为0.1 mol·L-1的溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4
难度: 中等查看答案及解析
-
下列有关电化学的叙述正确的是
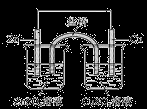
A.为实现铁上镀铜,可把铁作为阳极
B.氯碱工业通过电解熔融的NaCl生产Cl2
C.如上图所示,盐桥中的K+ 移向ZnSO4溶液
D.氢氧燃料电池(碱性电解质溶液)中O2通入正极,电极反应为O2+2H2O+4e-===4OH-
难度: 中等查看答案及解析
-
工业上常利用CO与SO2反应生成固态S单质和CO2,从而消除这两种气体对大气的污染:2 CO(g) + SO2(g)
2 CO2(g) + S(s) △H=-a kJ·mol-1(a>0),下列叙述正确的是
A.该反应的平衡常数表达式为K=
B.若反应开始时投入2 mol CO,则达平衡时,放出热量为a kJ
C.增大压强或升高温度都可以加快化学反应速率并提高SO2 的转化率
D.若单位时间内生成2 molCO2的同时,消耗1mol SO2,则说明反应达到平衡状态
难度: 中等查看答案及解析