-
化学与人类生活、社会可持续发展密切相关,下列措施有利于节能减排、保护环境的是( )
①加快化石燃料的开采与使用
②研发易降解的生物农药
③应用高效洁净的能源转换技术
④田间焚烧秸秆
⑤推广使用节能环保材料
A.①③⑤ B.②③⑤ C.①②④ D.②④⑤
难度: 简单查看答案及解析
-
下列说法中,正确的是
A.在化学反应过程中,发生物质变化的同时不一定发生能量变化
B.破坏生成物全部化学键所需要的能量大于破坏反应物全部化学键所需要的能量时,反应为吸热反应
C.生成物的总能量大于反应物的总能量时,反应吸热,ΔH>0
D.ΔH的大小与热化学方程式的化学计量数无关
难度: 简单查看答案及解析
-
将一定量硫酸、硝酸和KNO3溶液混合成100ml溶液,其中H2SO4、HNO3和KNO3的物质的量浓度分别是6mol/L,2mol/L和1mol/L,向其中加入过量的铁粉,可产生标准状况下的混合气体体积为
A.11.2 L B.6.72 L C.8.96 L D.4.48 L
难度: 极难查看答案及解析
-
下列叙述不正确的是 ( )
A. NH3易液化,液氨常用作制冷剂 B. NO、NO2都是有毒气体
C. 铵盐受热易分解,因此贮存铵态氮肥时要密封保存,并放在阴凉通风处 D. 稀HNO3和活泼金属反应时主要得到氢气
难度: 中等查看答案及解析
-
下列关于化学键的说法正确的是( )
①含有金属元素的化合物一定是离子化合物 ②第IA族和第ⅦA族原子化合时,一定生成离子键 ③由非金属元素形成的化合物一定不是离子化合物 ④活泼金属与非金属化合时,能形成离子键 ⑤离子键就是阴、阳离子间的相互引力 ⑥含有离子键的化合物一定是离子化合物 ⑦离子化合物中可能同时含有离子键和共价键
A.①②⑤ B.④⑥⑦ C.①④③ D.②③⑤
难度: 中等查看答案及解析
-
下列性质中,可以证明某化合物内一定存在离子键的是 ( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
难度: 中等查看答案及解析
-
元素的性质呈周期性变化的根本原因是( )
A. 元素原子量的递增,量变引起质变
B. 元素的原子半径呈周期性变化
C. 元素原子的核外电子排布呈周期性变化
D. 元素的金属性和非金属性呈周期性变化
难度: 中等查看答案及解析
-
运用元素周期律分析下面的推断,其中错误的是( )
A. 铍(Be)的氧化物的水化物可能具有两性
B. 砹(At2)为有色固体;HAt不稳定;AgAt感光性很强,不溶于水也不溶于稀酸
C. 硫酸锶(SrSO4)是难溶于水的白色固体
D. 硒化氢(H2Se)是比H2S稳定的气体
难度: 中等查看答案及解析
-
四种短周期元素的离子aXm+、bYn+、cZn﹣、dRm﹣,它们具有相同的电子层结构,若m>n,对下列叙述正确的是( )
①a﹣b=n﹣m ②元素的原子序数a>b>c>d
③元素非金属性Z>R ④最高价氧化物对应水化物的碱性X>Y
⑤还原性Rm﹣>Zn﹣⑥X一定可与冷水反应.
A. 只有②正确 B. ①②③④正确
C. ①②③⑥正确 D. ②③⑤正确
难度: 中等查看答案及解析
-
下列有关卤族元素的叙述不正确的是( )
A. 卤素单质从F2到I2,颜色加深,熔沸点升高
B. 卤族元素从Cl到I,最高价氧化物对应水化物的酸性减弱
C. 卤族元素从F到I, HX水溶液酸性增强
D. 卤素单质氧化性F2>Cl2>Br2>I2,因此排在前面的卤素单质均可将排在后面的卤素从它的盐溶液中置换出来
难度: 中等查看答案及解析
-
固体A的化学式为NH5,它的所有原子的最外电子层结构都符合相应稀有气体的最外电子层结构,则下列有关说法不正确的是( )
A. 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数的数值)
B. NH5中既有共价键又有离子键
C. NH5的电子式为
D. NH5与水反应的离子方程式为NH
+H-+H2O===NH3·H2O+H2↑
难度: 中等查看答案及解析
-
下列说法正确的是
A. 共价化合物中可能含有离子键
B. Ca2+、K+、Cl-、S2-四种离子的半径依次减小
C.
Po、
Po、
Po三种原子的核外电子数分别为124、125、126
D. ⅥA族元素氧、硫、硒(Se)的位置从上至下,故H2O、H2S、H2Se稳定性依次减弱
难度: 中等查看答案及解析
-
同温同压下,两个等体积的干燥圆底烧瓶中分别充满:①NH3,②NO2,进行喷泉实验。经充分反应后,瓶内溶液的物质的量浓度为
A.①>② B.①<② C.①=② D.不能确定
难度: 中等查看答案及解析
-
下列事实不能用于判断元素非金属性强弱的是( )
A. 非金属单质与非金属阴离子在溶液中发生的置换反应
B. 1 mol非金属单质在反应中得到电子的多少
C. 非金属元素的最高价氧化物对应水化物的酸性强弱
D. 非金属元素的单质与氢气反应的难易
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)===2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)===Na2CO3(s)+
O2(g) ΔH=-226 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A. CO的燃烧热为283 kJ
B. 下图可表示由CO生成CO2的反应过程和能量关系
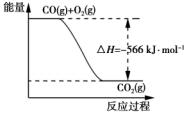
C. 2Na2O2(s)+2CO2(s)===2Na2CO3(s)+O2(g) ΔH>-452 kJ·mol-1
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
难度: 中等查看答案及解析
-
以NA表示阿伏加德罗常数,则关于热化学方程式:
C2H2(g)+
O2(g)===2CO2(g)+H2O(l) ΔH=-1300 kJ/mol的说法中,正确的是( )
A. 当有6 NA个电子转移时,该反应放出1300 kJ的能量
B. 当有1NA个水分子生成且为液体时,吸收1300 kJ的能量
C. 当有4NA个碳氧共用电子对生成时,放出1300 kJ的能量
D. 当有8NA个碳氧共用电子对生成时,放出1300 kJ的能量
难度: 中等查看答案及解析
-
下列有关化学用语表达正确的是( )
A. NH4Cl的电子式:
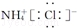 B. 氚表示为
B. 氚表示为T
C. 次氯酸的结构式为H﹣O﹣Cl D. 16O2和18O2互为同素异形体
难度: 中等查看答案及解析
-
已知3.6 g碳在 6.4 g氧气中燃烧,至反应物耗尽,共放出X kJ热量。已知单质碳的燃烧热为Y kJ/mol,则1 mol C与O2反应生成CO的反应热ΔH为
A.-Y kJ/mol B.-(5X-0.5Y) kJ/mol
C.-(10X-Y) kJ/mol D.+(10X-Y)kJ/mol
难度: 简单查看答案及解析
-
已知:P4(g)+6Cl2(g)===4PCl3(g) ΔH=a kJ·mol-1,P4(g)+10Cl2(g)===4PCl5(g) ΔH=b kJ·mol-1,P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ·mol-1,PCl3中P-Cl键的键能为1.2c kJ·mol-1。下列叙述正确的是
A.P—P键的键能大于P-Cl键的键能
B.可求Cl2(g)+PCl3(g)===PCl5(s)的反应热ΔH
C.Cl—Cl键的键能为(b-a+5.6c)/4 kJ·mol-1
D.P—P键的键能为(5a-3b+1
2c)/8 kJ·mol-1
难度: 中等查看答案及解析
-
将Mg、Cu组成的2.64 g混合物投入适量稀硝酸中恰好反应,固体完全溶解时收集到的还原产物NO气体0.896 L(标准状况),向反应后的溶液中加入2 mol/L的NaOH溶液60mL时金属离子恰好沉淀完全,则形成沉淀质量为 ( )
A. 4.32 g B. 4.68 g C. 5.36 g D. 6.38 g
难度: 困难查看答案及解析

