-
下列说法正确的是( )
A. 原子最外层电子数大于3(小于8)的元素一定是非金属元素
B. 原子最外层只有1个电子的元素一定是金属元素
C. 最外层电子数比次外层电子数多的元素一定位于第2周期
D. 某元素的离子的最外层与次外层电子数相同,该元素一定位于第3周期
难度: 中等查看答案及解析
-
1995年我国科研人员在兰州首次合成了镤元素的一种同位素镤-239,并测知其原子核内有148个中子。现有A元素的一种同位素,比镤-239的原子核内少54个质子和100个中子,则A元素在周期表中的位置是( )
A. 第三周期第ⅠA族 B. 第三周期第ⅡA族
C. 第四周期第ⅠA族 D. 第五周期第ⅠA族
难度: 中等查看答案及解析
-
将3.2 g铜粉与一定量的浓硝酸反应,当铜粉完全反应时收集到气体1.12 L(标准状况下)。则所消耗硝酸的物质的量是( )
A. 0.55mol B. 0.15 mol C. 0.3 mol D. 0.11mol
难度: 简单查看答案及解析
-
运用元素周期律分析下面的推断,其中错误的是( )。
A. 铍(Be)的氧化物的水化物可能具有两性
B. 砹(At)为白色固体,HAt不稳定,AgAt感光性很强
C. 硫酸锶(SrSO4)是难溶于水的白色固体
D. 硒化氢(H2Se)无色、有毒,比H2S更不稳定
难度: 中等查看答案及解析
-
只用一种试剂就能将NH4Cl、(NH4)2SO4、NaCl、Na2SO4四种溶液区分开,这种试剂是()
A. NaOH溶液 B. AgNO3溶液 C. Ba(OH)2溶液 D. BaCl2溶液
难度: 简单查看答案及解析
-
下列有关原子结构、元素性质的说法正确的是( )
A. Si、P、S、Cl元素的单质与氢气化合越来越容易
B. 元素原子最外层电子数越多,元素金属性越强
C. 元素周期表共有18列,第3列是第ⅠB族,第17列是第ⅦA族
D. F、O、Mg、Na原子半径逐渐减小
难度: 简单查看答案及解析
-
X、Y、Z是三种短周期元素,其中X、Y位于同一主族,Y、Z处于同一周期。X原子的最外层电子数是其电子层数的3倍。Z原子的核外电子数比Y原子少1。下列说法正确的是( )。
A. Y元素最高价氧化物对应水化物的化学式可表示为H3YO4
B. 三种元素的气态氢化物中,Z的气态氢化物最稳定
C. 原子半径由大到小的顺序为Z<Y<X
D. 元素非金属性由弱到强的顺序为Z<Y<X
难度: 简单查看答案及解析
-
下列事实能说明氯元素原子得电子能力比硫元素强的是( )
①HCl的溶解度比H2S大 ②HCl的酸性比H2S强 ③HCl的稳定性比H2S强 ④HCl的还原性比H2S强 ⑤HClO的酸性比H2SO4强 ⑥Cl2与铁反应生成FeCl3,而S与铁反应生成FeS ⑦Cl2能与H2S反应生成S ⑧还原性:Cl-<S2-
A. ③④⑤⑦⑧ B. ②③⑥⑦⑧
C. ③⑥⑦⑧ D. ①②③④⑤⑥⑦⑧
难度: 中等查看答案及解析
-
根据叙述判断,下列各元素一定属于主族元素的是( )
A. X元素能形成+7价的含氧酸及其盐。
B. Y元素的原子最外电子层上有2个电子。
C. Z元素的阴离子与同一周期稀有气体元素原子的电子层结构相同。
D. R元素的氧化物是酸性氧化物。
难度: 中等查看答案及解析
-
下列各组离子能在溶液中大量共存的是( )
A. Na+、Ag+、AlO
、Br- B. H+、Fe2+、SO
、NO
C. K+、NH
、CO
、OH- D. Ca2+、Al3+、NO
、Cl-
难度: 简单查看答案及解析
-
下列有关两种微粒
和
的叙述正确的是( )
A. 一定都是由质子、中子、电子组成的
B. 化学性质几乎完全相同
C. 核电荷数和核外电子数一定相等
D. 质子数一定相同,质量数和中子数一定不相同
难度: 中等查看答案及解析
-
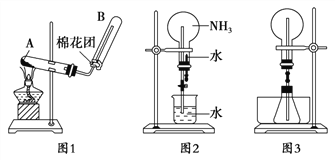
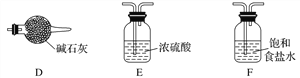
如图所示,夹子开始处于关闭状态,将液体A滴入试管②与气体B充分反应,打开夹子,可发现试管①内的水立刻沸腾了。则液体A和气体B的组合不可能是下列的是( )
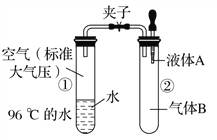
A. 氢氧化钠溶液、二氧化碳 B. 水、氨气
C. 氢氧化钠溶液、一氧化氮 D. 水、二氧化氮与氧气
难度: 简单查看答案及解析
-
如图,利用培养皿探究SO2的性质。实验时向Na2SO3固体上滴几滴浓硫酸,立即用另一表面皿扣在上面。

下表中对实验现象的描述或所做的解释不正确的是( )
选项
实验现象
解释
A
BaCl2溶液变浑浊
SO2与BaCl2溶液反应产生了BaSO3沉淀
B
Na2S溶液变浑浊
SO2与Na2S溶液反应产生了S单质
C
酸性KMnO4溶液褪色
SO2具有还原性
D
品红溶液褪色
SO2具有漂白性
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
2011年3月11日,日本福岛核电站因为9.0级大地震引发的海啸受损,产生严重的核泄漏。核泄漏物中含放射性元素碘-131,则有关碘-131(
I)和碘-127(
I)说法正确的是( )
A.
I和
I的中子数相同,是同一种核素
B.
I和
I的质子数相同,互为同位素
C.
I和
I的核外电子排布方式不同
D.
I有放射性而
I无放射性,说明两者化学性质不同
难度: 简单查看答案及解析
-
W、X、Y、Z是四种常见的短周期元素其原子半径随原子序数的变化如下图。

已知W一种核素的质量数为18,中子数为10;X和Ne原子的核外电子数相差1;Y的单质是一种常见的半导体材料;Z的非金属性在同周期中最强。下列说法正确的是 ( )
A. 对应的气态氢化物的稳定性:Y>Z
B. X的非金属性是同周期中最强的
C. 对应简单离子的半径:X>W
D. Y的氧化物能与X的最高价氧化物对应的水化物反应
难度: 简单查看答案及解析
-
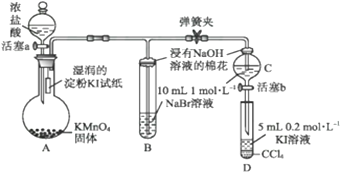
如下图是氨气催化氧化制备硝酸的实验装置,下列有关叙述正确的是( )
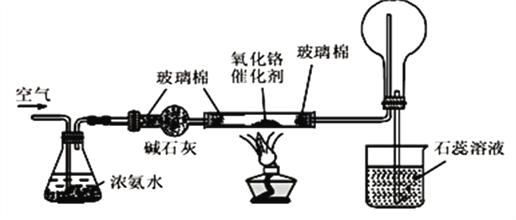
A. 三氧化二铬起氧化作用 B. 加热后,通过三氧化二铬的气体由无色变为红棕色
C. 烧杯中的紫色石蕊溶液不变色 D. 圆底烧瓶中的气体一定为无色
难度: 简单查看答案及解析
-
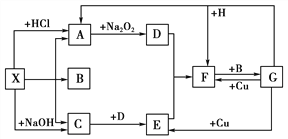
短周期元素A、B、C在元素周期表中的位置如右图所示。已知B、C两元素所在族数之和是A元素族数的2倍,B、C两元素的原子序数之和是A元素的4倍,则A、B、C是 ( )

A. Be、Na、Al B. B、Mg、S
C. O、P、Cl D. C、Al、P
难度: 简单查看答案及解析
-
将盛有1 mol NO和NO2混合气体的试管倒立于盛满水的水槽中,再通入0.4 mol O2,充分反应后,整个试管充满水。则原混合气体中NO与NO2体积比为( )
A. 1:2 B. 3:7 C. 2:5 D. 无法确定
难度: 简单查看答案及解析
-
下面是元素周期表的一部分(表中数字和X代表原子序数),其中X为53的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
某元素的一个原子形成的离子可表示为
,下列说法正确的是
A.
中含有的中子数为a+b B.
中含有的电子数为a−n
C. X原子的质量数为a+b+n D. 一个X原子的质量约为
g
难度: 简单查看答案及解析
-
如图表示第ⅠA族金属(又称为碱金属)的某些性质与核电荷数的变化关系,则下列各性质中不符合图示关系的是
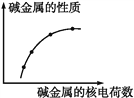
A. 金属性 B. 与水反应的剧烈程度
C. 阳离子的氧化性 D. 原子半径
难度: 简单查看答案及解析
-
下图是部分短周期元素原子半径与原子序数的关系图。则下列说法正确的是( )
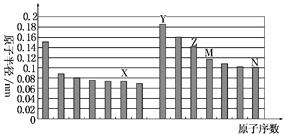
A. Z、N两种元素的离子半径相比,前者较大
B. X、N两种元素的气态氢化物的沸点相比,前者较低
C. 由X与M两种元素组成的化合物不能与任何酸反应,但能与强碱反应
D. Z的氧化物能分别溶解于Y的氢氧化物和N的氢化物的水溶液
难度: 简单查看答案及解析