-
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与l00mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g、FeCl20.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. l00mL的盐酸中HC1物质的量浓度为7.5mol/L
B. 生成的H2S气体在标准状况下的体积为2.24L
C. 该磁黄铁矿中FexS的x=0.85
D. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1
难度: 困难查看答案及解析
-
化学反应中,有时“一种物质过量,另一种物质仍不能完全反应”。下列反应中不存在此类情况的是
A. 氢气与过量的碘蒸气(500℃)
B. 铝片与过量浓硝酸(常温)
C. 铜粉与过量浓硝酸(常温)
D. 浓硫酸与过量铜片(共热)
难度: 中等查看答案及解析
-
下列表达方式错误的是( )
A. 甲烷的电子式:
B. 过氧化钠的电子式:
C. 碳-12原子:
D. 二氧化硅的结构式: O=Si=O
难度: 简单查看答案及解析
-
下列说法不正确的是( )
①质子数相同的微粒一定属于同一种元素
②同一元素的核素种数由中子数决定
③Cl2中35C1与37Cl两种核素的个数之比与HCl中35Cl与37C1的个数之比相等
④18gH2O中含有的中子数为10NA
⑤标况下,等体积CH4和HF所含的电子数相同
⑥只有活泼金属元素与活泼非金属元素之间才能形成离子键
⑦等物质的量的CN-和N2含有的共用电子对数相等
⑧通过化学变化可以实现16O与18O间的相互转化
A. 2个 B. 3个 C. 4个 D. 5个
难度: 中等查看答案及解析
-
右图表示食盐与水混合后微粒的示意图,则微粒A 表示
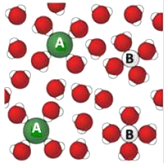
A. 水分子 B. 钠离子 C. 氯离子 D. 氢离子
难度: 简单查看答案及解析
-
某元素的一种同位素X的原子质量数为A,它与2H原子组成2HmX分子,此分子含N个中子,在ag2HmX中所含电子的物质的量是
A.
mol B.
mol
C.
mol D.
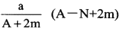 mol
mol难度: 简单查看答案及解析
-
短周期元素X、Y、Z在周期表中的位置如图所示,已知X与Y的原子序数之和等于Z的原子序数。下列说法正确的是

A. Y的单质与水反应时,Y的单质既是氧化剂又是还原剂
B. X的最高价氧化物对应水化物与其气态氢化物可以反应生成盐
C. X、Y、Z元素形成的单质,常温下Z单质的沸点最低
D. 单质的氧化性:Y<Z
难度: 简单查看答案及解析
-
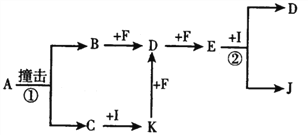
“封管实验”具有简易、方便、节约、绿色等优点,下列关于三个“封管实验”(夹持装置未画出)的说法正确的是( )
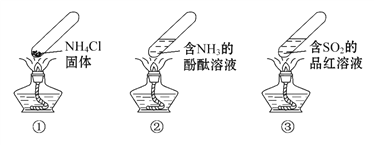
A. 加热时,①中上部汇集了NH4Cl固体
B. 加热时,②中溶液变红,冷却后又都变为无色
C. 加热时,③中溶液红色褪去,冷却后溶液变红,体现SO2的漂白性
D. 三个“封管实验”中所发生的化学反应都是可逆反应
难度: 中等查看答案及解析
-
CCTV-1《焦点访谈》栏目中曾报道“铊中毒事件”,铊的相关信息如下图所示。下列有关卡片信息解读不正确的是
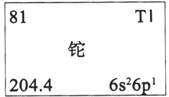
A. 铊的元素符号为Tl B. 铊的金属性比铝的金属性弱
C. 铊位于第六周期ⅢA D. 铊原子的质子数为81
难度: 简单查看答案及解析
-
位于不同主族的四种短周期元素甲、乙、丙、丁,其原子序数依次增大,原子半径r(丁) >r(乙)> r(丙)> r(甲)。四种元素中,只有一种为金属元素,乙和丙原子的最外层电子数之和为丁原子的最外层电子数的3倍。据此推断,下述不正确的是
A. 丙的简单氢化物分子间存在氢键
B. 由甲、乙两元素组成的化合物中,可形成10电子分子
C. 由甲和丙两元素组成的分子不止一种
D. 乙和丁两元素的最高价氧化物的水化物之间能发生反应
难度: 中等查看答案及解析