-
人类将在未来几十年内逐渐由“碳素燃料文明时代”过渡至“太阳能文明时代”(包括风能、生物质能等太阳能的转换形态),届时人们将适应“低碳经济”和“低碳生活”。下列说法不正确的是 ( )
A、太阳能电池可将太阳能直接转化为电能
B、发展太阳能经济有助于减缓温室效应
C、煤、石油和天然气都属于碳素燃料
D、对“从菠菜叶中分离出蛋白质并制成电池”的研究仍属于碳素燃料文明范畴
难度: 简单查看答案及解析
-
下列化学用语或模型图表示正确的是 ( )
A.甲烷的球棍模型:
B.S2—的结构示意图为:
C.乙炔的最简式 CH≡CH D.羟基的电子式
难度: 简单查看答案及解析
-
随着科学技术的不断进步,研究物质的手段和途径越来越多,N
、H3、O4、C60等已被发现。下列有关说法中,正确的是 ( )
A. N
中含有36个电子 B. O2和O4属于同位素
C. C60晶体是原子晶体 D. H2和H3属于同素异形体
难度: 简单查看答案及解析
-
设NA 为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,80gSO3所占的体积约为22.4L
B.25℃时,pH=13的1.0LBa(OH)2溶液中含有的OH-数目为0.2NA
C.电解精炼铜时,当转移了2 mol电子时,阳极上溶解的铜原子数一定为NA
D.标准状况下11.2 L NH3溶于1 L水中,溶液中含N原子的微粒总数为0.5 NA
难度: 简单查看答案及解析
-
下列有关物质分类或归类正确的一组是 ( )
① 液氨、液氯、干冰、碘化银均为化合物 ② 氢氟酸、盐酸、水玻璃、氨水均为混合物 ③ 明矾、小苏打、醋酸、次氯酸均为电解质 ④ 碘酒、牛奶、豆浆、漂粉精均为胶体 ⑤ Na2O2 、Na2CO3、Na2SiO3均为钠盐
A. ①和② B. ②和③ C. ③和④ D. ②③⑤
难度: 简单查看答案及解析
-
能正确表示下列反应的离子方程式的是 ( )
A. 足量硫酸铝溶液与纯碱反应:2Al3++3CO
+3H2O = 2Al(OH)3 ↓ +3CO2↑
B.碳酸氢钠溶液与少量石灰水反应:HCO3-+Ca2++OH- =CaCO3↓+H2O
C. 苯酚与碳酸钠溶液反应:2C6 H5 OH+CO
= 2C6 H5 O-+CO2 ↑+H2O
D. 碳酸钡与硫酸溶液反应:Ba2++SO
= BaSO4↓
难度: 简单查看答案及解析
-
在溶液中能大量共存的一组离子是 ( )
A.强酸溶液中:K+、Fe2+、NO2-、SO
B、Na+、CO32-、SO
、Fe3+
C、FeC12溶液中:K + 、Na+、SO
、A1O2- D、Na+、CH3COO—、CO
、NH4+
难度: 简单查看答案及解析
-
已知短周期元素的离子。
都具有相同的电子层结构,则下列叙述正确的是 ( )
A、原子半径:A>B>C>D B、原子序数:d>c>b>a
C、离子半径:C>D>B>A D、单质的还原性:A>B>D>C
难度: 简单查看答案及解析
-
在一定温度下的密闭容器中,加入1 mol CO和1 mol H2O发生反应:CO(g)+H2O(g)
CO2(g)+H2(g),达到平衡时测得n(H2)为0.5mol,下列说法不正确的是 ( )
A、在该温度下平衡常数K=1 B、平衡常数与反应温度无关
C、CO的转化率为50% D、其他条件不变时,改变压强平衡不移动
难度: 简单查看答案及解析
-
醋酸溶液中存在电离平衡:CH3 COOH H++CH3 COO-,下列叙述不正确的是 ( )
A. CH3 COOH 溶液中离子浓度的关系满足:c(H+)= c(OH-)+c(CH3 COO-)
B. 0.1 mol ·L-1的CH3 COOH 溶液加水稀释,溶液中c(OH-)减小
C. CH3 COOH 溶液中加入少量CH3 COONa 固体,平衡逆向移动
D. 常温下, pH=2的CH3 COOH 溶液与pH=12的NaOH 溶液等体积混合后,溶液的pH<7
难度: 简单查看答案及解析
-
关于浓度均为0.1mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是 ( )
A. c(NH
):③>① B. 水电离出的c(H+):②>①
C. ①和②等体积混合后的溶液:c(H+)=c(OH-)+c(NH3·H2O)
D. ①和③等体积混合后的溶液:c(NH
)>c(C1-)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
镁及其化合物一般无毒(或低毒)、无污染,且镁原电池放电时电压高而平稳,使镁原电池越来越成为人们研制绿色原电池的关注焦点。其中一种镁原电池
放电
的反应为:xMg+Mo3 S4 Mgx Mo3 S4,下列说法错误的是 ( )
充电
A. 放电时,负极反应为Mg —2e- Mg2+
B. 放电时,Mo3 S4发生氧化反应
C. 放电过程中Mg2+向正极迁移
D. 充电时,阳极反应为Mgx MO3 S4 —2xe- Mo3 S4+xMg2+
难度: 简单查看答案及解析
-
用锌、氧化铜、稀硫酸作原料制取铜,有下列两种途径:
(1)Zn H2 Cu
(2)CuO CuSO4 Cu
若用这两种方法制得相同质量的铜时,下列叙述符合实际实验结果的是( )
A. 生成的硫酸锌质量相同 B. 耗相同质量的硫酸
C. 消耗相同质量的锌 D. 耗相同质量的氧化铜
难度: 简单查看答案及解析
-
麦考酚酸是一种有效的免疫抑制剂,能有效地防止肾移植排斥,其结构简式如下图所示。下列有关麦考酚酸说法正确的是 ( )
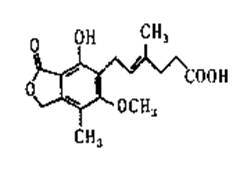
A.分子式为C17H23O6
B.不能与FeC13溶液发生显色反应
C.在一定条件下可发生加成、取代、消去反应
D.l mol麦考酚酸最多能与3 mol NaOH反应
难度: 简单查看答案及解析
-
用下列实验装置进行的实验,能达到相应的实验目的的是
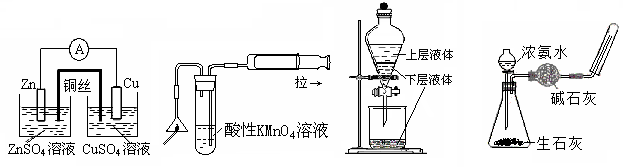
D.制取氨气
C.分液操作
B.检验火柴头
燃烧产生的SO2
A.铜锌原电池
难度: 简单查看答案及解析
-
有Fe2+、NO
、Fe3+、NH
、H+和H2O六种粒子,分别属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是( )
A. 氧化剂与还原剂的物质的量之比为1:8
B. 该过程说明Fe(NO3)2 溶液不宜加酸酸化
C. 若有1 mol NO
发生氧化反应,则转移8 mol电子
D. 若把该反应设计为原电池,则负极反应为Fe2+ — e- = Fe3+
难度: 简单查看答案及解析
-
用含1 mol HCl的盐酸酸化含1 mol MgSO4的溶液,当向其中滴加1 mol/L 的Ba(OH)2 溶液时,产生沉淀的物质的量(n)与加入Ba(OH)2 溶液体积(V)间的关系图正确的是 ( )
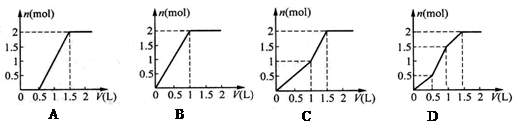
难度: 简单查看答案及解析
-
Na2O2、HC1、A12O3三种物质在水溶液中完全反应后,溶液中只含有Na+、H+、C1-、OH-,且溶液呈中性,则Na2O2、HC1、A12O3的物质的量之比可能( )A、3:2:1 B、2:4:1 C、2:3:1 D、4:2:1
难度: 简单查看答案及解析

