-
(单选题)四种主族元素的离子aXm+、bYn+、cZn-和 dRm-(a、b、c、d为元素的原子序数),它们具有相同的电子层结构,若m>n,则下列叙述的判断正确的是( )
①a-b=n-m ②元素的原子序数a>b>c>d ③元素非金属性Z>R ④最高价氧化物对应水化物碱性X>Y.
A.②③正确
B.只有③正确
C.①②③④正确
D.①②③正确难度: 中等查看答案及解析
-
吸进人体内的氧有2%转化为氧化性极强的活性氧,这些活性氧能加速人体衰老,被称为“生命杀手”,中国科学家尝试用Na2SeO3清除人体内的活性氧,则Na2SeO3的作用是( )
A.还原剂
B.氧化剂
C.既是氧化剂又是还原剂
D.以上均不是难度: 中等查看答案及解析
-
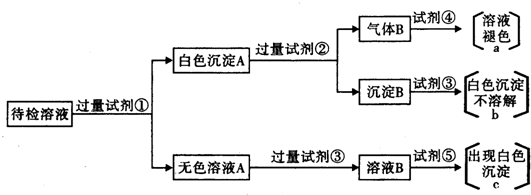
根据下列实验事实,得出的结论正确的是( )
A.某试液无明显现象
有红棕色气体放出,说明原试液中不含有NO3-,加入浓硫酸后生成NO3-,
B.某试液有红褐色沉淀生成
沉淀溶解,溶液呈紫色,则说明原试液中可能含有
C.某试液产生黄色沉淀,证明原试液中一定含I-
D.某试液溶液显红色,证明原试液一定是碱溶液
难度: 中等查看答案及解析
-
下列反应的离子方程式正确的是( )
A.饱和FeCl3溶液滴入沸水中:Fe3++3H2O⇌Fe(OH)3↓+3H+
B.硫酸氢钠溶液中加入氢氧化钡溶液至溶液pH=7:Ba2++SO42-=BaSO4↓
C.氯化铝溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O
D.氯化亚铁溶液中滴入溴水:2Fe2++Br2=2Fe3++2Br-难度: 中等查看答案及解析
-
常温时0.1mol•L-1HA溶液的pH>1,0.1mol•L-1BOH溶液中c(OH-):c(H+)=1012,将两溶液等体积混合,以下判断一定正确的是( )
A.c(A-)=c(OH-)+c(HA)
B.c(OH-)<c(H+)<c(B+)<c(A-)
C.c(H+)+c(B+)=c(A-)+c(OH-)
D.c(A-)=c(B+)>c(H+)=c(OH-)难度: 中等查看答案及解析
-
下列各组离子中,在碱性溶液中共存,且在加入盐酸过程中会产生沉淀和气体的是( )
A.Na+、NO3-、AlO2-、SO42-
B.Na+、CO32-、SiO32-、K+
C.K+、Cl-、AlO2-、HCO3-
D.Na+、Cl-、HCO3-、Ca2+难度: 中等查看答案及解析
-
在反应容器中充入1molA气体和n molB气体,在一定条件下发生反应:A(气)+nB(气)⇌mC(气),达平衡时,测得A的转化率为50%,在相同温度和相同压强下,平衡时混合气体的体积是反应前的
,则n和m的数值可能是( )
A.n=1 m=1
B.n=2 m=2
C.n=3 m=3
D.n=2 m=3难度: 中等查看答案及解析