-
化学与生活、社会密切相关,下列说法错误的是
A.玻璃属于无机非金属材料 B.煤的气化属于物理变化
C.雾霾与汽车尾气的排放有关 D.甲醛的水溶液可以用来浸泡标本
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.4.6g 金属钠与足量乙醇反应放出2.24L氢气
B.50mL 18.4 mol/L浓硫酸与足量铜加热反应,生成SO2分子的数目为0.46NA
C.1mol羟基(—OH)中含电子数为10NA
D.常温下,10L pH=12的Na2CO3溶液中含有的OH-离子数目为0.1NA
难度: 中等查看答案及解析
-
某有机物的结构简式为
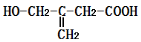 ,该有机物不可能发生的化学反应是
,该有机物不可能发生的化学反应是A.还原 B.水解 C.氧化 D.取代
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.AlCl3溶液中通入过量的氨水:Al3++4NH3·H2O=AlO2-+2H2O+4NH4+
B.向NH4 HCO3溶液中加过量NaOH 溶液并加热:NH4++OH-
NH3↑+H2O
C.将Cu片加入稀硝酸中:3Cu+8H++2NO3- =3Cu2++2NO↑+4H2O
D.向Na2S2O3溶液中加入稀硫酸:2S2O32—+2H+=SO42—+3S↓+H2O
难度: 中等查看答案及解析
-
利用下列有关实验装置进行的相应实验,能达到实验目的的是
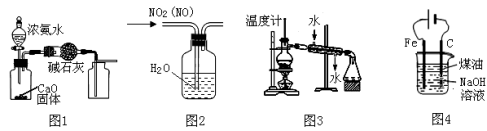
A.用图1装置制取并收集干燥的NH3
B.用图2装置可除去NO2中的NO
C.用图3装置分离两种互溶但沸点相差较大的液体混合物
D.用图4装置制备Fe(OH)2并能较长时间观察其颜色
难度: 中等查看答案及解析
-
钠-硫(Na/S8)电池是由固体电解质将两个液体电极隔开(如图),一个由钠-β-氧化铝固体电解质做成的中心管,将内室的熔融钠(熔点98℃)和外室的熔融硫(熔点119℃)隔开,并允许Na+ 通过。下列有关说法错误的是
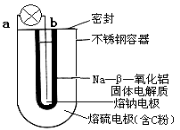
A.放电时b为电池的负极
B.充电时阴极反应式为:Na++e—=Na
C.充电时,阳极处发生还原反应
D.放电时Na+ 可以穿过固体电解质流向a电极
难度: 中等查看答案及解析
-
由下列实验现象得出的结论正确的是
选项
实验现象
结论
A
取某Na2SO3溶液,加入足量的稀盐酸,产生气泡,再滴加BaCl2溶液,产生白色沉淀。
Na2SO3已部分被氧化
B
向2mL0.1mol/LNaOH溶液中滴加0.1mol/LMgCl2溶液3滴,出现白色沉淀后,再滴加3滴0.1mol/L FeCl3溶液,出现红褐色沉淀。
溶解度:Mg(OH)2>Fe(OH)3
C
向氯水中通入足量SO2,氯水褪色。
SO2具有漂白性
D
相同温度下,测等浓度的Na2CO3和Na2SO3水溶液的pH: pH (Na2CO3) > pH(Na2SO3)。
非金属性强弱:C>S
难度: 困难查看答案及解析
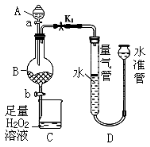
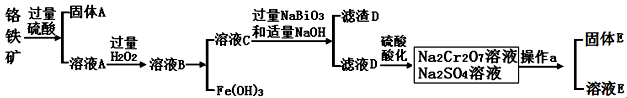
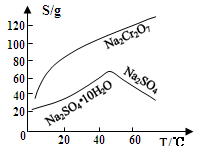

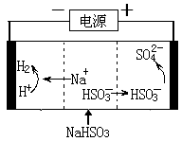
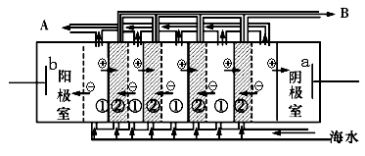
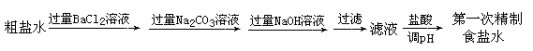
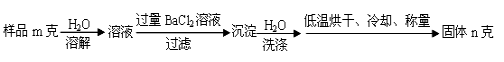
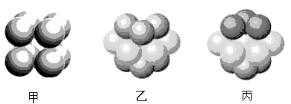
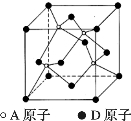
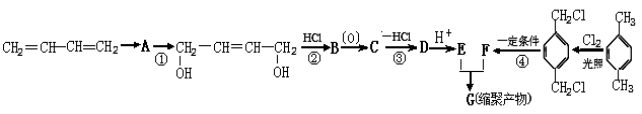
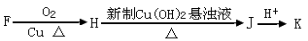 。K是合成涤纶的重要原料之一,写出下列化学方程式:
。K是合成涤纶的重要原料之一,写出下列化学方程式: