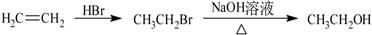-
向CuSO4溶液中逐滴加入KI溶液至过量,观察到有沉淀(CuI)生成,且溶液变为棕色,再向反应后的混合物中不断通入SO2气体,溶液逐渐变成无色。下列有关分析中正确的是
A.上述实验条件下,物质的氧化性:Cu2+>SO2>I2
B.在SO2与I2反应中得到的还原产物为H2SO4
C.通入SO2后溶液逐渐变成无色,体现了SO2的漂白性
D.滴加KI溶液时.每转移2mole-会生成2molCuI沉淀
难度: 简单查看答案及解析
-
化学与社会、生产、生活密切相关。下列说法中不正确的是
A.煤炭经气化、液化和干馏等过程,可以转化为淸洁能源
B.利用二氧化碳来制造全降解塑料,可以缓解温室效应
C.高纯硅可用于制造太阳能电池、计算机芯片和光异纤维
D.在医疗上.可用碳酸氢钠治疗胃酸过多症
难度: 简单查看答案及解析
-
实验室中某些气体的制取、收集、尾气处理(或性质实验)装置如图所示,用此装置和下表中提供的物质完成相关实验,其中合理的选项是
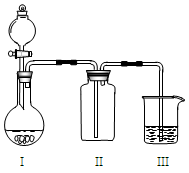
选项
I中的物质
II中收集的气体
III中的物质
A
Cu和浓硝酸
NO
NaOH溶液
B
浓盐酸和高锰酸钾
Cl2
NaOH溶液
C
大理石和稀硫酸
CO2
澄清石灰水
D
浓氨水和CaO
NH3
滴加酚酞的水
难度: 中等查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.标准状况下,22.4L的CH3Cl中所含质子数为26NA
B.将100mL0.1mol/L的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒的数目为0.01NA
C.常温下,1L0.1mol/L醋酸中含有的离子总数为0.2NA
D.0.1molC2H2气体中,原子间含有的共用电子对数目为0.3NA
难度: 中等查看答案及解析
-
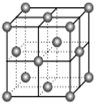
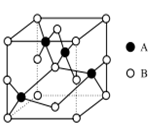
X、Y、Z、W、Q五种短周期元素在元素周期表中的位置如图所示,其中X元素原子的最外层电子数是最内层电子数的3倍,则下列说法一定正确的是
X
Y
Z
W
Q
A.X、W能分别与钠形成摩尔质量相同且阴、阳离子个数比为1:2的化合物
B.X和Z只能形成一种离子化合物
C.氧化物对应的水化物酸性:W<Q
D.原子半径大小关系:Q>W>Z>Y
难度: 简单查看答案及解析
-
下列有关离子方程式正确的是
A.将氟气通入水中:F2+ H2O=H++F++HFO
B.将磁性氧化铁溶于盐酸:Fe3O4+8H+=2Fe3++Fe2++4H2O
C.硝酸银溶液中滴加过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
D. 往KAl(SO4)2溶液中滴入Ba(OH)2溶液至沉淀的物质的量最大
Al3++2SO42-+2Ba2++4OH-=AlO2-+2BaSO4↓+2H2O
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A.能使石蕊显红色的溶液:K+、Mg2+、HCO3-、SO42-
B.水电离出来的 c(H+)=10-13mol·L-1的溶液:NH4+、Fe2+、NO3-、Cl-
C.c(H+)/c(OH-)=1012的溶液:K+、Fe3+ 、Cl-、SO42-
D.加入铝片能放出H2的溶液:Na+、CH3COO-、Cu2+、SO42-
难度: 简单查看答案及解析
-
甲、乙、丙、X是中学化学中常见的4种物质,其转化关系如图,其中甲和X不可能是
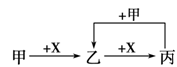
A.甲为C2H5OH、X为O2 B.甲为H2S、X为O2
C.甲为HNO3 、X为Fe D.甲为AlCl 3 溶液、X为NaOH溶液
难度: 中等查看答案及解析
-
下列有关化学用语的表示中正确的是
A.CO2的电子式:
B.聚丙烯的结构简式:

C.中子数为20的氯原子:
Cl
D.镁离子的结构示意图:
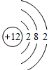
难度: 简单查看答案及解析
-
对下列图像的描述正确的是
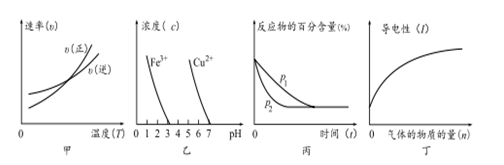
①根据图甲可判断反应的ΔH <0 ②根据图乙,除去CuSO4溶液中的Fe3+,可加入CuO调节pH至3~5 ③图丙可表示压强(p)对反应2A(g)+2B(g)
3C(g)+D(s)的影响 ④图丁可表示向醋酸溶液中通入氨气时,溶液导电性随氨气量的变化的情况
A.①③ B.②④ C.③④ D.①②
难度: 困难查看答案及解析
-
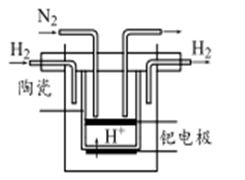
Na-S电池的结构如图所示,电池反应为2Na+
S8 =Na2Sn。下列说法不正确的是
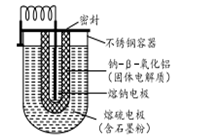
A.熔钠电极作电池的负极 B.放电时Na+向正极移动
C.充电时熔钠电极与电源的正极相连 D.充电时阳极反应式为8Sn2- —16e-=nS8
难度: 简单查看答案及解析
-
某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g)
2
SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
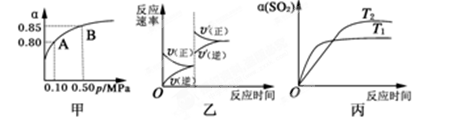
A.由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B.由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C.达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
难度: 简单查看答案及解析
-
常温下,CaSO4[Ksp(CaSO4)=9×10-6] 在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是

A.在任何溶液中,c(Ca2+)·c(SO42-)均相等
B.d点溶液通过蒸发可以变到c点
C.b点对应的Ksp大于a点对应的Ksp
D.b点将有沉淀生成,平衡后溶液中c(SO42-)一定小于3×10-3 mol·L-1
难度: 简单查看答案及解析
-
设NA阿伏伽德罗常数的值。己知反应
(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l) △H1=a kJ/mol
(2)CH4(g)+2O2(g)═CO2(g)+2H2O(g) △H2=b kJ/mol,其它数据如表:
化学键
C═O
O═O
C-H
O-H
键能kJ·mol-1
798
x
413
463
下列说法正确的是
A.上表中 x=(1796+b)/2
B.H2O(g)═H2O(l) △S<0,△H═(a-b )kJ/mol
C.当有4NA个C-H键断裂时,该反应放出热量一定为a kJ
D.利用反应(1)设计的原电池电解精炼铜时,当负极输出0.2NA个电子时,电解槽的阳极质量一定减轻6.4g
难度: 简单查看答案及解析