-
对Na、Mg、Al的有关性质的叙述正确的是:
A. 碱性:NaOH< Mg(OH)2< Al(OH)3 B. 第一电离能:Na< Mg <Al
C. 电负性:Na> Mg >Al D. 还原性:Na> Mg >Al
难度: 中等查看答案及解析
-
下列关于晶体的说法中,不正确的是
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性 ②含有金属阳离子的晶体一定是离子晶体 ③共价键可决定分子晶体的熔、沸点 ④晶胞是晶体结构的基本单元,晶体内部的微粒按一定规律作周期性重复排列
A.①② B.②④ C.①④ D.②③
难度: 中等查看答案及解析
-
以下各分子(或离子)中,所有原子都满足最外层为8电子结构的是
A.H3O+ B.BF3 C.CCl4 D.PCl5
难度: 中等查看答案及解析
-
某元素原子价电子构型3d54S2,其应在
A、第四周期ⅡA族 B、第四周期ⅡB族
C、第四周期ⅦA族 D、第四周期ⅦB族
难度: 简单查看答案及解析
-
下列关于能层与能级的说法中正确的是:
A、原子核外电子的每一个能层最多可容纳的电子数为2n2
B、任一能层的能级总是从s能级开始,而且能级数不一定等于该能层序数
C、同是s能级,在不同的能层中所能容纳的最多电子数是不相同的
D、1个原子轨道里最多只能容纳2个电子,但自旋方向相同。
难度: 中等查看答案及解析
-
氨气分子空间构型是三角锥形,而甲烷是正四面体形,这是因为
A.两种分子的中心原子杂化轨道类型不同,NH3为sp2型杂化,而CH4是sp3型杂化。
B.NH3分子中N原子形成三个杂化轨道,CH4分子中C原子形成4个杂化轨道。
C.NH3分子中有一对未成键的孤对电子,它对成键电子的排斥作用较强。
D.氨气分子是极性分子而甲烷是非极性分子。
难度: 中等查看答案及解析
-
关于氢键,下列说法正确的是
A.每一个水分子内含有两个氢键
B.冰、水中都存在氢键
C.分子间形成的氢键使物质的熔点和沸点降低
D.H2O是一种非常稳定的化合物,这是由于氢键所致
难度: 中等查看答案及解析
-
下列各组物质中,都是由极性键构成极性分子的一组是
A.CH4和H2O B.CO2和HCl C.NH3和H2S D.HCN和BF3
难度: 中等查看答案及解析
-
下列叙述中,正确的是
A.在一个基态多电子的原子中,可以有两个运动状态完全相同的电子
B.在一个基态多电子的原子中,不可能有两个能量完全相同的电子
C.在一个基态多电子的原子中,M层上的电子能量肯定比L层上的电子能量高
D.某基态原子错误的核外电子排布图为
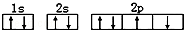 该排布图违背了泡利原理
该排布图违背了泡利原理难度: 中等查看答案及解析
-
关于CO2说法正确的是
A.碳原子采取sp3杂化 B.CO2是直线型结构
C.干冰是原子晶体 D.CO2为极性分子
难度: 简单查看答案及解析
-
在气相中,关于BeF2和SF2的说法错误的是
A.BeF2分子中,中心原子Be的价层电子对数等于2,其空间排布为直线,成键电子对数也等于2
B.BeF2分子的立体结构为直线形
C.SF2分子中,中心原子S的价层电子对数等于4,其空间排布为四面体,成键电子对数等于2,没有孤对电子
D.在气相中,BeF2是直线形而SF2是V形
难度: 中等查看答案及解析
-
关于化学式为[TiCl(H2O)5]Cl2·H2O的配合物的下列说法中正确的是
A.配位体是Cl-和H2O,配位数是9
B.中心离子是Ti4+,配离子是[TiCl(H2O)5]2+
C.内界和外界中的Cl-的数目比是1:2
D.加入足量AgNO3溶液,所有Cl-均被完全沉淀
难度: 中等查看答案及解析
-
在有机物中,若碳原子上连接的四个原子或原子团不相同,则这个碳原子称为手性碳原子。含有手性碳原子的分子一般是手性分子具有镜像异构及光学活性,下列分子中具有光学活性的是
A.CBr2F2 B.CH3CH2OH C.CH3CH2CH3 D.CH3CH(OH)COOH
难度: 中等查看答案及解析
-
下列说法中正确的是
A.分子中共价键键能越高,键长越长,则分子越稳定
B.元素周期表中的ⅡA族和ⅦA族元素的原子间不能形成共价键
C.水分子可表示为H—O—H,分子中键角为180°
D.N—N、N===N、N≡N键能之比为1.00:2.17:4.90,说明N2分子中π键键能>σ键键能
难度: 中等查看答案及解析
-
以下现象与核外电子跃迁有关的是
①霓虹灯发出有色光 ②棱镜分光 ③激光器产生激光 ④石油蒸馏 ⑤凸透镜聚光 ⑥燃放的焰火在夜空中呈现五彩缤纷的礼花 ⑦日光灯通电发光 ⑧冷却结晶
A.①③⑥⑦ B.②④⑤⑧
C.①③⑤⑥⑦ D.①②③⑤⑥⑦
难度: 中等查看答案及解析
-
现有短周期主族元素X、Y、Z、R、T。R原子最外层电子数是电子层数的2倍;Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成的Z2T 化合物能破坏水的电离平衡。六种元素的原子半径与原子序数的关系如图所示。下列推断正确的是
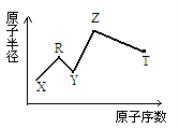
A.原子半径和离子半径均满足:Y<Z
B.氢化物的沸点排序 :Y>T>R
C.最高价氧化物对应的水化物的酸性 :T<R
D.由X、R、Y、Z四种元素组成的化合物水溶液一定显酸性
难度: 中等查看答案及解析
-
下列几种氢键:①O—H…O,②N—H…N,③F—H…F,④O—H…N,其强度由强到弱的排列顺序是
A.③①④② B.①②③④
C.③② D.①④③②
难度: 中等查看答案及解析
-
下列各组微粒中,都互为等子体的是
A.CO、NO、NaH、N2 B.SO2、NO2+、N3-、CNO-
C.CO32-、NO3-、BeCl2 D.SiF4、SiO44-、SO42-、PO43-
难度: 中等查看答案及解析
-
下列有关说法不正确的是
A.C3H8中碳原子都采用的是sp3杂化
B.O2、CO2、N2都是非极性分子
C.酸性:H2CO3<H3PO4<H2SO4<HClO
D.CO的一种等电子体为NO+,它的电子式为
难度: 中等查看答案及解析
-
六氟化硫分子呈正八面体形(如图所示),在高电压下仍有良好的绝缘性,在电器工业方面有着广泛的用途,但逸散到空气中会引起温室效应。下列有关六氟化硫的推测正确的是
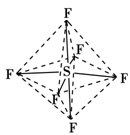
A.六氟化硫易燃烧生成二氧化硫
B.六氟化硫中各原子均达到8电子稳定结构
C.六氟化硫分子中的S—F键都是σ键,且键长、键能都相等
D.六氟化硫分子是极性分子
难度: 中等查看答案及解析
 BF4-的熔点(填>、=或<),其原因是__
BF4-的熔点(填>、=或<),其原因是__