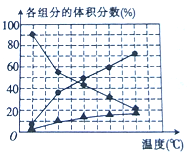
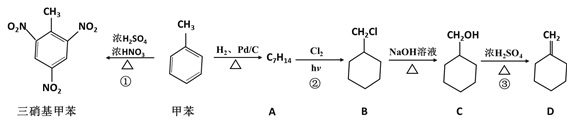
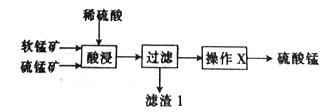
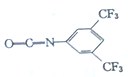
-
将下列物质加入氨水中,不能使溶液变浑浊的是
A. BaCl2 B. MgCl2 C. FeCl3 D. AlCl3
难度: 中等查看答案及解析
-
下列分子中,电子总数不为18的是
A. H2S B. C2H6 C. N2H4 D. H2O
难度: 中等查看答案及解析
-
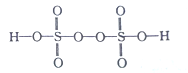
在一定条件下,O2F2可以发生反应:H2S+3O2F2=SF4+2HF+3O2。则O2F2中O的化合价为 ( )
A. -2 B. -1 C. +1 D. +2
难度: 中等查看答案及解析
-
下列过程中没有发生化学反应的是
A. 用石灰石来燃煤固硫 B. 用活性炭来吸附废水中的悬浮物
C. 实验室用H2O2和MnO2来制取O2 D. 光束通过Fe(OH)3 胶体时产生丁达尔效应
难度: 中等查看答案及解析
-
下列有关乙烯、乙醇、乙酸的说法错误的是
A. 聚乙烯的单体是乙烯
B. 乙醇不存在同分异构体
C. 乙醇可以被酸性重铬酸钾溶液氧化为乙酸
D. 相同物质的量的乙烯与乙醇分别在氧气中完全燃烧,消耗O2的量不同
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的数值,下列叙述正确的是
A. 7.8g Na2O2中含有的阴离子数为0.1NA
B. 0.1 mol 16 OD- 中含有的中子数为NA
C. 常温常压下,42g 乙烯中所含有的共用电子对数目为6NA
D. 2 mol NO与1 mol O2在密闭容器中充分反应后,产物的分子数为2NA
难度: 中等查看答案及解析
-
下列关于实验的叙述中正确的是
A. 向某溶液中加入足量CaCl2溶液,若产生白色沉淀,则溶液中一定含有大量的CO32-
B. 向饱和BaCO3溶液中滴入饱和Na2SO4溶液,有白色沉淀生成,证明Ksp(BaSO4)>Ksp(BaCO3)
C. 用NaCO3溶液可以鉴别物质的量浓度之比为1:1的稀盐酸和稀硫酸
D. 分液时,分液漏斗中的下层液体从下口放出,上层液体从上口倒出
难度: 中等查看答案及解析
-
2017年6月5日是第46个世界环境日,其活动主题是“人人参与,创建绿色家园”。下列行为与该主题相吻合的是

A. 践行环保低碳生活 B. 驾驶私家车出行 C. 推广燃烧煤炭供热 D. 使用含磷洗涤剂
难度: 中等查看答案及解析
-
下列描述正确的是
A. 氯水的标签上应标注:
 B. S2-的结构示意图:
B. S2-的结构示意图:
C. 苯的分子式:
D. BeCl2的电子式:
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是
A. 钠与水反应:2Na+2H2O=2Na+ + 2OH- +H2↑
B. 电解饱和食盐水获取碱和氯气:2Cl-+2H2O
Cl2↑+H2↑+2OH-
C. 向碳酸氢铵溶液中加入过量石灰水:Ca2+ +HCO3- +OH-=CaCO3 ↓+H2O
D. 向氢氧化钡溶液中加入稀硫酸:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O
难度: 中等查看答案及解析
-
“碳呼吸电池”是一种新型能源装置,其工作原理如图所示。下列有关说法中错误的是
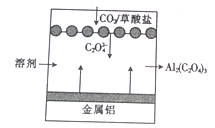
A. 该装置将化学能转变为电能
B. 利用该技术可捕捉大气中的CO2
C. 该装置工作时,正极上的电极反应式为2CO2-2e-=C2O42-
D. 该装置工作时,理论上每生成1 mol 草酸铝,电路中通过6 mol 电子
难度: 中等查看答案及解析
-
某温度下,在一定体积的恒容密闭容器中进行可逆反应:X(g)+Y(g
Z(g) + W(s) △H>0,下列叙述正确的是
A. 加入少量Z,逆反应速率增大
B. 当容器中气体压强不变时,反应达到平衡
C. 升高温度,平衡向逆反应方向移动
D. 平衡后,加入X,该反应的△H增大
难度: 中等查看答案及解析