-
全球变暖给我们敲响了警钟,地球正面临巨大的挑战.下列说法不正确的是( )
A.推广“低碳经济”,减少温室气体的排放
B.利用晶体硅制作的太阳能电池可将太阳能直接转化为电能
C.推广“绿色自由”计划,吸收空气中的CO2并利用廉价能源合成汽油
D.推进小火力发电站的兴建,缓解地方用电困难,促进地方经济的快速发展
难度: 简单查看答案及解析
-
氨水中所含有的分子和离子有( )
①
②H2O ③NH3 ④NH3·H2O ⑤H+ ⑥OH-
A. ①②③ B. ①②③④⑤⑥ C. ②③④⑤⑥ D. ②③④⑤
难度: 简单查看答案及解析
-
某酸溶液中C(H+)=0.1mol·L-1,则该酸溶液的物质的量浓度 ( )
A.一定等于0.1mol·L-1 B.一定大于0.1mol·L-1
C.一定小于0.1mol·L-1 D.无法确定
难度: 简单查看答案及解析
-
醋酸溶液中滴入稀氨水,溶液的导电能力发生变化,其电流I随加入氨水的体积V的变化曲线图是
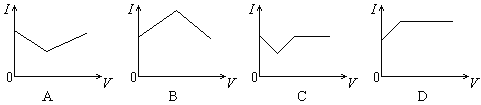
难度: 简单查看答案及解析
-
下列溶液中导电性最强的是( )
A.
醋酸 B.
溶液
C.
盐酸 D.
溶液
难度: 简单查看答案及解析
-
下列溶液一定呈中性的是( )
A.pH=7的溶液 B.c(H+)=c(OH-)=10-6mol/L溶液
C.酸与碱恰好完全反应生成正盐的溶液D. 使石蕊试液呈紫色的溶液
难度: 简单查看答案及解析
-
下列事实一定能说明HF是弱酸的是( )
①常温下NaF溶液的pH大于7; ②用HF溶液做导电性实验,灯泡很暗;
③HF与NaCl不能发生反应;④常温下0.1mol/L的HF溶液的pH为2.3
⑤HF能与Na2CO3溶液反应,产生CO2气体; ⑥HF与水能以任意比混溶
⑦1mol/L的HF水溶液能使紫色石蕊试液变红
A.①④ B.②③⑤ C.③④⑥ D.①②⑦
难度: 简单查看答案及解析
-
pH相同的氨水.NaOH和Ba(OH)2溶液,分别用蒸馏水稀释到原来的X.Y.Z倍,稀释后三种溶液的pH仍然相同,则X.Y.Z的关系是( )
A. X=Y=Z B. X=Y<Z C.X<Y=Z D. X>Y=Z
难度: 简单查看答案及解析
-
现有浓度为1 mol/L的五种溶液:①HCl,②H2SO4,③CH3COOH,④NH4Cl,⑤NaOH,由水电离出的C(H+)大小关系正确的是( )
A.④>③>①=⑤>② B.①=②>③>④>⑤
C.②>①>③>④>⑤ D.④>③>①>⑤>②
难度: 简单查看答案及解析
-
0.1mol/LNaOH溶液和0.1mol/LNH4Cl溶液等体积混合后,溶液中离子浓度大小顺序正确的是
A.c(Na+)>c(Cl-)>c(OH-)>c(H+)
B.c(Na+)=c(Cl-)>c(H+)>c(OH-)
C.c(Na+)=c(Cl-)>c(OH-)>c(H+)
D.c(Cl-)>c(Na+)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
甲溶液的pH=6,乙溶液的pH=2,则下列叙述正确的是( )
A.甲、乙两溶液的c(H+)之比为400:1
B.甲中水的电离程度与乙中水的电离程度无法比较
C.甲中水的电离程度小于乙中水的电离程度
D.甲、乙两溶液均呈酸性
难度: 简单查看答案及解析
-
一种pH=3的酸溶液和一种pH=11的碱溶液等体积混合后测得溶液的pH=5.6其原因可能是:( )
A.浓的强酸和稀的弱碱溶液反应
B.浓的弱酸和稀的强碱溶液反应
C.等浓度的强酸和弱碱溶液反应
D.生成了一种强酸弱碱盐
难度: 简单查看答案及解析
-
25℃时,在浓度均为1mol/L的(NH4)2SO4、(NH4)2CO3、(NH4)2Fe(SO4)2、三种溶液中,若测得其中c(NH4+)分别为a、b、c(单位为mol/L),则下列判断正确的是( )
A. a=b=c B. b>a>c C. c>a>b D.a>c>b
难度: 简单查看答案及解析
-
用水逐步稀释0.1 mol/L的氨水,若温度保持不变,则始终保持增大趋势的是 ( )
A.c(OH-) B.c(NH4+)/c(NH3·H2O) C.c(NH3·H2O) D.c(NH4+)
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.pH=3的酸溶液稀释100倍后,pH =5
B.在相同温度下,pH =3的溶液和pH =5的溶液相比,前者H+浓度是后者的100倍
C.相同温度,相同浓度的钾盐溶液中,酸式盐的pH 一定小于正盐的pH
D.碳酸钠溶液在室温时pH大于60℃时的pH(同一浓度的Na2CO3溶液)
难度: 简单查看答案及解析
-
下列物质的溶液加热蒸发至干、灼烧,所得固体的成分不相同的是( )
A. FeCl2、Fe2(SO4)3 B. FeCl2、FeCl3
C.NaHCO3、Na2CO3 D.Mg(HCO3)2、MgCl2
难度: 简单查看答案及解析
-
将硫酸铵溶于水得无色溶液,为使该溶液中的铵根离子与硫酸根离子的物质的量浓度之比等于2,应当采取的措施是( )
A、加入适量的硫酸溶液,抑制铵根离子的水解
B.加入适量的氨水,使pH值等于7
C.加入适量氢氧化钠,使溶液pH值等于7
D.加入适量硫酸钠,抑制硫酸铵电离
难度: 简单查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A. 氯化铝溶液中加入过量氨水:
Al3+ + 4NH3•H2O
AlO2- + 4NH4+ + 2H2O
B. 澄清石灰水与少量苏打溶液混合:
Ca2+ + OH- + HCO3-
CaCO3↓ + H2O
C. 氯化亚铁溶液中通入氯气:2Fe2+ + Cl2
2Fe3+ + 2Cl-
D. 碳酸钙溶于醋酸CaCO3 + 2H+
Ca2+ + CO2↑ + H2O
难度: 简单查看答案及解析
-
下列叙述正确的是( )
A.在0.1mol·L-1CH3COONa溶液中,c (OH-)==c(CH3COOH)+c(H+)
B.10 mL 0.02mol·L-1HCl溶液与10 mL 0.02mol·L-1Ba(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=10
C.0.1mol·L-1氨水中,c(OH-)==c(NH4+)
D.0.1mol·L-1某二元弱酸强碱盐NaHA溶液中,c(Na+)==2c(A2-)+c(HA-)+c(H2A)
难度: 简单查看答案及解析
-
物质的量浓度相同的三种盐NaX、NaY、NaZ的溶液,其pH依次为8、9、10,则HX、HY、HZ的酸性由强到弱的顺序是( )
A.HX、HY、HZ B.HX、HZ、HY
C.HZ、HY、HX D.HY、HZ、HX
难度: 简单查看答案及解析
-
表示0.1mol·L-1NaHCO3溶液有关微粒浓度的关系正确的( )
A.c(Na+)+c(H+)=c(HCO3-)+c(CO32-)+c(OH-) B.c(Na+)=c(HCO3-)+c(CO32-)+c(H2CO3)
C.c(Na+)>c(HCO3-)>c(CO32-)>c(H+)>c(OH-) D.c(OH-)=c(H+)+c(H2CO3)+c(HCO3-)
难度: 简单查看答案及解析
-
pH=13的 强碱与pH=2的强酸溶液混合,所得混合液的pH=11,则强碱与强酸的体积比为
A.9:1 B.1:11 C.11:1 D.1:9
难度: 简单查看答案及解析
-
把Ca(OH)2放入蒸馏水中,一段时间后达到如下平衡:Ca(OH)2(固)
Ca2++2OH-,下列说法正确的是( )
A.给溶液加热,溶液的pH升高
B.恒温下向溶液中加入CaO,溶液的pH升高
C. 向溶液中加入Na2CO3溶液,则其中Ca(OH)2的固体增多
D. 向溶液中加入少量CH3COONa晶体,则其中Ca(OH)2的固体增多
难度: 简单查看答案及解析
-
pH、体积都相同的醋酸和硫酸,分别跟足量的碳酸钠溶液反应,在相同条件下放出CO2气体的体积( )
A.醋酸多 B.硫酸多 C.一样多 D.无法比较
难度: 简单查看答案及解析
-
常温时,将pH=8的NaOH溶液与pH=10的NaOH溶液等体积混合后,溶液的氢离子浓度最接近于( )
A.(10-8+10-10)mol/L B. 2×10-10 mol/L
C. 1/2(10-8+10-10)mol/L D. (10-4+10-6)mol/L
难度: 简单查看答案及解析
-
准确量取25.00 mL高锰酸钾溶液,可选用的仪器是( )
A.50 mL量筒 B.10mL量筒
C. 50mL碱式滴定管 D.50mL酸式滴定管
难度: 简单查看答案及解析
-
某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等4种阴离子。若向其中加入足量的Na2O2后,溶液中离子浓度基本保持不变的是 ( )
A. CO32- B.SO32- C.CH3COO- D.HCO 3-
难度: 简单查看答案及解析
-
下列各组离子,在水溶液中能大量共存的是( )
①I-、ClO-、
、H+ ②K+、
、
、OH- ③
、
、Cl-、OH- ④Fe2+、Cu2+、
、Cl- ⑤H+、K+、
、
⑥Ca2+、Na+、
、
A.①和⑥ B. ①和④ C.②和⑤ D. ③和④
难度: 简单查看答案及解析
-
要求设计实验证明某种盐的水解是吸热的,有四位学生分别作出如下回答,其中正确的是( )
A.甲学生:将硝酸铵晶体溶于水,若水温下降,说明硝酸铵水解是吸热的
B.乙学生:在盐酸中加入相同温度的氨水,若实验过程中混合液温度下降,说明盐类水解是吸热的
C.丙学生:在醋酸钠溶液中加入醋酸钠晶体,若溶液温度下降,说明盐类水解是吸热的
D.丁学生:在醋酸钠溶液中滴入酚酞试液,加热后若红色加深,说明盐类水解是吸热的
难度: 简单查看答案及解析
-
.能表示人体大量喝水时,胃液的pH变化的图象是( )
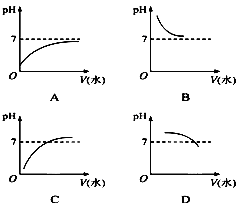
难度: 简单查看答案及解析
