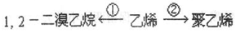-
下列说法正确的是
A.铜、石墨均导电,所以它们均是电解质
B.NH3、CO2的水溶液均导电,所以NH3、CO2均是电解质
C.液态HC1、固体NaCl均不导电,所以HC1、NaCl均是非电解质
D.蔗糖、酒精在水溶液或熔融状态下均不导电,所以它们均是非电解质
难度: 简单查看答案及解析
-
下列离子既能电离又能水解,且能与强碱溶液反应的是
A.HS- B.HSO4- C.CH3COO- D.CO32-
难度: 简单查看答案及解析
-
在相同温度下,100mL 0.lmol·L-1的醋酸与10mL l mol·L-1的醋酸相比较,下列说法正确的是
A.发生中和反应时所需NaOH的量前者大于后者
B.溶液pH前者小于后者
C.己电离出的H+的物质的量前者大于后者
D.所含CH3COOH的物质的量前者大于后者
难度: 简单查看答案及解析
-
25℃时,在等体积的①pH=0的H2SO4溶液②0.05 mol·L-1的Ba(OH)2溶液③ PH=10的Na2S溶液④pH=5的NH4NO3溶液中,发生电离的水的物质的量之比是
A.1:10:104:109 B.1:5:5×109:5×108 C.1:20:1010:109 D.1:10:1010:109
难度: 简单查看答案及解析
-
下列有关实验的说法正确的是
A.用干燥的pH试纸测定新制氯水的pH
B.若25.00 mL滴定管中液面的位置在刻度为3.00mL处,则滴定管中液体的体积一定大于22.00mL
C.中和滴定实验中,洗净后的锥形瓶一定要用待测液润洗2-3次
D.用玻璃棒蘸取溶液滴在表面皿上的己润湿pH试纸上测其pH,一定有误差
难度: 简单查看答案及解析
-
下图是用0.1000 mol·L-1NaOH溶液滴定20.00mL未知浓度盐酸(酚酞做指示剂)的滴定曲线。下列说法正确的是
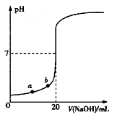
A.水电离出的氢离子浓度:a > b
B.盐酸的物质的量浓度为0.0100 mol·L-1
C.当指示剂由红色变为无色时,达滴定终点
D.当滴加NaOH溶液10.00 mL时,该混合液的pH= l+lg3
难度: 简单查看答案及解析
-
常温下,下列溶液中的微粒浓度关系正确的是
A.新制氯水中加入足量固体NaOH: c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH = 8.3 的 NaHCO3溶液:c(Na+)> c(HCO3-) > c(CO32-) > c(H2CO3)
C.pH=11的氨水与pH=3的盐酸等体积混合:c(Cl-)=c(NH4+) > c(OH-) =c(H+)
D.0.2mol/LCH3COOH溶液与0.lmol/L NaOH溶液等体积混合:
2c (H+) - 2c(OH-) =c(CH3COO-) - c(CH3COOH)
难度: 简单查看答案及解析
-
下列有关问题,与盐类水解有关的是
①NH4C1与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4) 3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干FeCl3溶液并灼烧得到Fe2O3固体
A.①②③④⑤ B.②③④ C.①④⑤ D.①②③
难度: 简单查看答案及解析
-
下列四种溶液均为0.l00mol/L ①NH4Cl ②NH4HSO4 ③NH4Fe(SO4)2 ④NH3 • H2O,下列描述有几项正确
A.①②③显酸性,④显碱性
B.c(NH4+):④<①<③<②
C.溶液的pH:①<②<④
D.②溶液中:c (NH4+) +c (H+)=c (SO42-)+c (OH-)
A.1项 B.2项 C.3项 D.4项
难度: 中等查看答案及解析
-
在不同温度下,水达到电离平衡时c(H+)与c(OH-)的关系如图所示,下列说法中正确的是
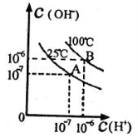
A.100℃时,pH=12的NaOH溶液和pH=2的H2SO4溶液等体积混合时恰好中和,所得溶液的pH等于7
B.25℃时,0.2mol/L Ba(OH)2 溶液和0.2 mol/L HC1溶液等体积混合,所得溶液的pH等于7
C.25℃时,0.2 mol/L NaOH溶液与 0.2 mol/L醋酸等体积混合后恰好中和,所得溶液pH大于7
D.25℃时,pH=12的氨水和pH=2的H2SO4溶液等体积混合,所得溶液的pH小于7
难度: 简单查看答案及解析
-
在T ℃时,铬酸银(Ag2CrO4)在水溶液中的沉淀溶解平衡曲线如图所示,下列说法中不正确的是
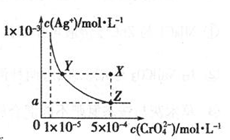
A.向饱和Ag2CrO4溶液中加入固体K2CrO4能使溶液由Y点变为X点
B.T℃时,在Y点和Z点,Ag2CrO4的Ksp相等
C.T℃时,Ag2CrO4 的 Ksp数值为 1×10-11
D.图中a=
×10-4
难度: 简单查看答案及解析
-
下列混合溶液中,各离子浓度的大小顺序正确的是
A.10mL 0.lmol/L 氨水与 l0mL 0.lmol/L 盐酸混合 c(Cl-) > c(NH4+) > c(OH-) > c(H+)
B.10mL 0.lmol/L NH4Cl溶液与 5mL 0.2 mol/L NaOH溶液混合c(NH4+) >c(Cl-)>c(OH-) >c(H+)
C.l0mL 0.lmol/LCH3COOH溶液与5mL 0.2mol/L NaOH 溶液混合, c(Na+) = c(CH3COO-) > c(OH-) = c(H+)
D.10mL 0.5mol/L CH3COONa 溶液与5mL lmol/L 盐酸混合c(Cl-) = c(Na+) > c(H+) > c(OH-)
难度: 简单查看答案及解析
-
电离度是描述弱电解质电离程度的物理量,电离度=(己电离的物质的量/原来的总物质的量)X 100%。现取20 mL pH=4的CH3COOH溶液,加入0.2 mol • L-1的氨水,测得溶液导电性变化如下图,则加入氨水前CH3COOH的电离度为
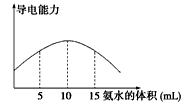
A.0.5% B.0.1% C.1.5% D.1%
难度: 中等查看答案及解析
-
酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是
A.HB-水解方程式:HB-+H2O
H3O++ B2-
B.溶液中离子浓度大小为:c(Na+) > c(HB-)> c(B2-) > c(OH-) > c(H+)
C.NaHB的存在促进了水的电离
D.相同物质的量浓度溶液的pH值:NaHB > Na2B
难度: 简单查看答案及解析
-
乙烷在光照的条件下与氯气混和,最多可以生成几种物质
A.6 种 B.7 种 C.9 种 D.10 种
难度: 简单查看答案及解析
-
下列有机物命名正确的是
A.4—甲基一3—乙基戊烷 B.2,2—二氯乙烷
C.2,2—二甲基一1—丁烯 D.3,3—二甲基一1一丁烯
难度: 简单查看答案及解析
-
某炔烃含有一个三键,与H2发生加成后的产物为:
 则该炔烃可能具有的结构有
则该炔烃可能具有的结构有A.1种 B.2种 C.3种 D.4种
难度: 中等查看答案及解析
-
下列说法中正确的是
A.分子式均满足CnH2n+2的两种烃不一定是同系物
B.可单独用溴水或酸性KMnO4溶液除去乙烷中的乙烯
C.相同质量的乙烯和甲烷完全燃烧后产生的水的质量相同
D.乙烯使溴水和酸性KMnO4溶液褪色的原理相同
难度: 中等查看答案及解析
-
某烃和溴水反应的产物为2,2,3,3-四溴丁烷,则该烃同分异构体为
A.1—丁烯 B.1—丁炔 C.2—丁炔 D.2—丁烯
难度: 简单查看答案及解析
-
某高分子化合物的结构简式如下:
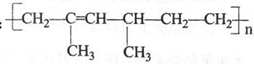 则其单体的名称为
则其单体的名称为A.2,4—二甲基—2—己烯 B.2,4—二甲基-1,3-己二烯
C.乙烯和2-甲基-1,3-戊二烯 D.乙烯和2-甲基-1,3-丁二烯
难度: 简单查看答案及解析