-
现用胆矾配制0.1mol/L的硫酸铜溶液,下列操作中合理的是( )
A.称量时,将胆矾晶体直接放在托盘天平的右盘上
B.准确称取16.0g胆矾,在1000mL容量瓶中溶解,定容
C.准确称取25.0g胆矾,溶于水,所得溶液恢复到室温,再转移至1000mL容量瓶中,洗涤并转移,定容
D.定容摇匀后发现溶液体积低于刻度线,再补加少量蒸馏水至刻度线难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.硫酸与氢氧化钡溶液反应:H++OH-=H2O
B.用FeCl3腐蚀Cu制作印刷电路板:Fe3++Cu=Fe2++Cu2+
C.向氯化铝溶液中加入过量的氨水:Al3++4OH-=AlO2-+2H2O
D.实验室用氢氧化钠溶液吸收多余的Cl2:Cl2+2OH-=Cl-+ClO-+H2O难度: 中等查看答案及解析
-
CO、H2在一定条件下合成乙醇:2CO(g)+4H2(g)⇌CH3CH2OH(g)+H2O(g),正反应为放热反应.下列说法错误的是( )
A.反应物的总能量大于生成物的总能量
B.增大H2浓度可以使CO转化率达到100%
C.使用合适的催化剂、升高温度均可加大反应速率
D.反应达到平衡时,正反应和逆反应的化学反应速率相等且不为零难度: 中等查看答案及解析
-
为实现扼制温室效应,使用下列燃料可实现二氧化碳的零排放的是( )
A.氢气
B.天然气
C.汽油
D.乙醇汽油难度: 中等查看答案及解析
-
下列物质属于离子化合物的是( )
A.C60
B.HCl
C.C6H6
D.CaCl2难度: 中等查看答案及解析
-
下列各物质完全燃烧,产物除二氧化碳和水外,还生成其他物质的是( )
A.甲烷
B.丁烯
C.氯乙烯
D.乙醇难度: 中等查看答案及解析
-
下列气态氢化物最稳定的是( )
A.HCl
B.HBr
C.HF
D.HI难度: 中等查看答案及解析
-
下列有关化学能与热能的说法正确的是( )
A.油脂在人体中氧化是吸热反应
B.H2→H+H的变化需要吸收能量
C.凡经加热而发生的化学反应都是吸热反应
D.若某反应生成物的总能量大于反应物的总能量,则该反应为放热反应难度: 中等查看答案及解析
-
下列物质中,能够导电的是( )
A.二氧化碳气体
B.硫酸溶液
C.蔗糖溶液
D.固体氯化钠难度: 中等查看答案及解析
-
下列标志中,应贴在装有浓硫酸的容器上的是( )
A.
B.
C.
D.
难度: 中等查看答案及解析
-
光纤通讯和半导体成像技术已得到了广泛应用.光纤的主要成分是( )
A.Si
B.SiO2
C.Na2SiO3
D.CaSiO3难度: 中等查看答案及解析
-
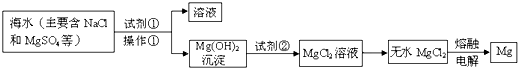
海水是一个巨大的化学资源库,下列有关海水综合利用的说法正确的是( )
A.利用潮汐发电是将化学能转化为电能
B.海水蒸发制海盐的过程中发生了化学变化
C.从海水中可以得到MgCl2,电解熔融MgCl2可制备Mg
D.海水中含有溴元素,只需经过物理变化就可以得到溴单质难度: 中等查看答案及解析
-
某中学一实验小组组装了下列所示实验装置,其中能达到实验目的是( )
A.
分离碘酒中的碘和酒精
B.
实验室制氨气
C.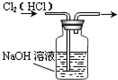
除去Cl2中的HCl
D.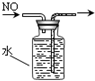
排出集气法收集NO难度: 中等查看答案及解析
-
下列描述不正确的是( )
A.二氧化氮溶于水时生成硝酸和一氧化氮,工业上利用这一原理生产硝酸
B.液氨汽化时要吸收大量的热,因此氨常用作制冷剂
C.食品包装袋中常放入小袋的生石灰,目的是防止食品氧化变质
D.提倡使用无氟冰箱,主要是为了保护大气臭氧层难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.NaCl的电子式:
B.乙烯的结构简式:CH2CH2
C.Mg原子结构示意图:
D.乙酸乙酯的分子式:C4H8O2难度: 中等查看答案及解析
-
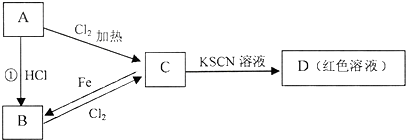
在水溶液中能大量共存的离子组是( )
A.Mg2+、NH4+、Cl-、OH-
B.Na+、AlO2-、CO32-、OH-
C.Ca2+、Fe2+、H+、NO3-
D.Fe3+、K+、SCN-、SO42-难度: 中等查看答案及解析
-
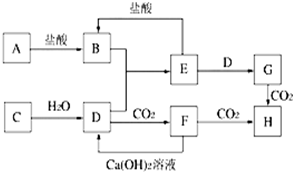
制备单质硅的主要化学反应如下:
①SiO2+2CSi+2CO↑ ②Si+2Cl2
SiCl4 ③SiCl4+2H2
Si+4HCl
下列对上述三个反应的叙述中,错误的是( )
A.①③为置换反应
B.①②③均为氧化还原反应
C.三个反应的反应物中硅元素均被氧化
D.①、③中的C和H2均为还原剂难度: 中等查看答案及解析
-
下列说法正确的是( )
A.在标准状况下,22.4 L苯所含分子数目为6.02×1023
B.1 mol/L K2SO4溶液所含K+数目为2×6.02×1023
C.在常温常压下,16 g O2和O3的混合气体所含原子数目为6.02×1023
D.2.4 g Mg与足量盐酸完全反应时,失去电子数目为0.1×6.02×1023难度: 中等查看答案及解析
-
下列实验的设计可行的是( )
A.用澄清石灰水可区别Na2CO3和NaHCO3粉末
B.
用图装置进行浓硝酸与铜的反应制取并收集NO2
C.检验未知溶液是否含SO42ˉ可先加氯化钡,再加稀盐酸
D.除去粗盐中的Ca2+、Mg2+、SO42-,依次加入的物质是H2O、BaCl2、Na2CO3、HCl难度: 中等查看答案及解析
-
下列除去杂质的方法错误的是( )
物质 杂质 试剂 主要操作 A SiO2 Fe2O3 盐酸 过滤 B Mg Al NaOH 过滤 C FeCl2 FeCl3 Mg 过滤 D KNO3 KCl H2O 冷却结晶
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
对下列有机反应类型的认识中,错误的是( )
A.;取代反应
B.CH2=CH2+Br2CH2Br-CH2Br;加成反应
C.2CH3CH2OH+O22CH3CHO+2H2O;取代反应
D.CH3COOH+CH3CH2OHCH3COOCH2CH3+H2O;酯化反应
难度: 中等查看答案及解析
-
如图是某同学做完Zn-Cu原电池实验后所做的读书卡片记录,其中描述合理的组合是( )

A.①②③
B.②③④
C.③④⑤
D.④⑤⑥难度: 中等查看答案及解析
-
Na2CO3和H2SO4反应的下列各组实验中,反应速率最快的一组是( )
组号 温度(℃) Na2CO3的状态 H2SO4浓度(mol/L) A 20 块状 3 B 30 小颗粒 2 C 30 块状 4 D 30 小颗粒 4
A.A
B.B
C.C
D.D难度: 中等查看答案及解析
-
短周期主族元素A、B、C、D,原子序数逐渐增大.其中A与D为同族元素,原子半径A<D<C<B,A原子最外层电子数是次外层的3倍,B、C的核外电子数之和与A、D核外电子数之和相等.下列说法正确的是( )
A.简单离子半径:B>A
B.最高价氧化物对应水化物的碱性:B<C
C.气态氢化物的稳定性:A<D
D.B、C、D最高价氧化物的水化物间可两两反应难度: 中等查看答案及解析
-
将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol•L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为( )
A.5.52g
B.(m+6.8)g
C.(m+2.55)g
D.(m+12.0)g难度: 中等查看答案及解析