-
下列叙述不正确的是( )
A. 在镀件上电镀铜时,可用金属铜作阳极
B. 镀层破损后,白铁(镀锌)比马口铁(镀锡)更易被腐蚀
C. 工业上电解饱和食盐水制烧碱,NaOH在阴极产生
D. 钢铁在发生析氢腐蚀和吸氧腐蚀时,完全相同的反应是负极反应
难度: 中等查看答案及解析
-
有A、B、C、D四种金属,当A、B组成原电池时,电子流动方向A →B ;当A、D组成原电池时,A为正极;B与E构成原电池时,电极反应式为:E2++2e-=E,B-2e-=B2+则A、B、D、E金属性由强到弱的顺序为( )
A. A﹥B﹥E﹥D B. A﹥B﹥D﹥E
C. D﹥A﹥B﹥E D. D﹥E﹥A﹥B
难度: 中等查看答案及解析
-
废电池的污染引起人们的广泛关注,废电池对环境污染的主要物质是( )
A. 石墨 B. 二氧化锰 C. 锌 D. 汞
难度: 简单查看答案及解析
-
在同温同压下,下列各组热化学方程式中Q2>Ql的是
A. 2H2(g)+O2(g)=2H2O(g);△H=-Q1 2H2(g)+O2(g)=2H2O(1); △H=-Q2
B. S(g)+O2(g)=SO2(g); △H=-Q1 S(s)+O2(g)=SO2(g); △H=-Q2
C. C(s)+O2(g)=CO2(g); △H=-Q1 C(s)+1/2O2 (g)=CO(g); △H=-Q2
D. H2(g)+Cl2(g)=2HCl(g);△H=-Q1 1/2H2(g)+1/2Cl2(g)=HCl(g);△H=-Q2
难度: 中等查看答案及解析
-
已知2Zn(s)+O2(g)===2ZnO(s) ΔH=-701.0 kJ·mol-1
2Hg(l)+O2(g)=2HgO(s) ΔH=-181.6 kJ·mol-1
则反应Zn(s)+HgO(s)===ZnO(s)+Hg(l)的ΔH为( )
A. +519.4 kJ·mol-1 B. +259.7 kJ·mol-1
C. -519.4 kJ·mol-1 D. -259.7 kJ·mol-1
难度: 中等查看答案及解析
-
化学用语是学习化学的重要工具,下列用来表示物质变化的化学用语中,正确的是( )
A. 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-===Cl2↑
B. 氢氧燃料电池的负极反应式:O2+2H2O+4e-===4OH-
C. 粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-===Cu2+
D. 钢铁发生电化学腐蚀的负极反应式:Fe-3e-===Fe3+
难度: 中等查看答案及解析
-
在锌和稀硫酸制氢气的反应中,要使反应速率加快应采取的措施是( )。
A. 加入少量硫酸铜溶液 B. 加入少量氯化锌溶液
C. 用纯锌替换有杂质的锌 D. 把稀硫酸换成浓硫酸
难度: 困难查看答案及解析
-
关于如图所示装置的叙述,正确的是( )
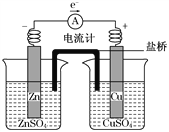
A. 铜是阳极,铜片上有气泡产生
B. 铜片质量逐渐减少
C. 电流从锌片经导线流向铜片
D. 铜离子在铜片表面被还原
难度: 简单查看答案及解析
-
将一直流电源的正、负极,分别接在一张用食盐水、碘化钾淀粉溶液和酚酞试液浸湿的滤纸上,经过一段时间后,两极附近滤纸的颜色分别是( )
A
B
C
D
阳极
白
红
蓝
蓝
阴极
蓝
蓝
红
蓝
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列图示中关于铜电极的连接错误的是 ( )
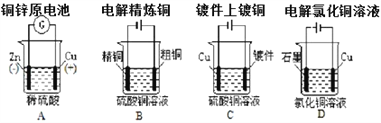
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
把锌片和铁片放在盛有稀食盐水和酚酞试液的表面皿中,装置如图所示,先观察到变红的区域是( )

A. Ⅰ和Ⅲ B. Ⅰ和Ⅳ C. Ⅱ和Ⅲ D. Ⅱ和Ⅳ
难度: 中等查看答案及解析
-
金属镍有广泛的用途。粗镍中含有少量Fe、Zn、Cu、Pt等杂质,可用电解法制备高纯度的镍,下列叙述正确的是( )(已知:氧化性Fe2+<Ni2+<Cu2+)
A. 阳极发生还原反应,其电极反应式:Ni2+ + 2e— = Ni
B. 电解过程中,阳极质量的减少与阴极质量的增加相等
C. 电解后,电解槽底部的阳极泥中只有Cu和Pt
D. 电解后,溶液中存在的金属阳离子只有Fe2+ 和Zn2+
难度: 中等查看答案及解析
-
如图所示是探究发生腐蚀的装置图。发现开始时U形管左端红墨水水柱下降,一段时间后U形管左端红墨水水柱又上升。下列说法不正确的是
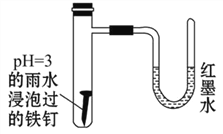
A. 两种腐蚀负极的电极反应式均为Fe-2e-=Fe2+
B. 开始时发生的是析氢腐蚀
C. 一段时间后发生的是吸氧腐蚀
D. 析氢反应的总反应式为2Fe+O2+2H2O=2Fe(OH)2
难度: 中等查看答案及解析
-
右图为直流电源电解稀Na2SO4水溶液的装置,通电后在石墨电极a和b附近分别滴加石蕊溶液,下列实验现象正确的是( )
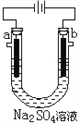
A. 逸出气体的体积:a电极的小于b电极的
B. a电极附近呈蓝色,b电极附近呈红色
C. a电极附近呈红色,b电极附近呈蓝色
D. 一电极逸出无味气体,另一电极逸出刺激性气味气体
难度: 中等查看答案及解析
-
电瓶车所用电池一般为铅蓄电池,这是一种典型的可充电电池,电池总反应式为Pb+PbO2+4H++2SO42-
2PbSO4+2H2O, 则下列说法正确的是( )
A. 放电时:当外电路通过1mol的电子时,理论上负极板的质量增加了151.5g
B. 充电时:阳极反应是PbSO4-2e-+2H2O = PbO2+SO42-+4H+
C. 放电时:正极反应是Pb-2e-+SO42-= PbSO4
D. 充电时:铅蓄电池的阴极应与电源的正极相连
难度: 中等查看答案及解析
-
镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:Cd+2NiO(OH)+2H2O
Cd(OH)2+2Ni(OH)2,下列叙述中正确的是( )
A. 该电池放电的时候,负极材料是Ni(OH)2
B. 放电时每转移3mol的电子时,正极有3mol的NiO(OH)被氧化
C. 充电时,阴极附近pH增大
D. 充电时,阳极反应是Cd(OH)2 + 2e- = Cd + 2 OH-
难度: 中等查看答案及解析
-
将铂电极放置在KOH溶液中,然后分别向两极通入CH4和O2即可产生电流,称为燃料电池,下列叙述正确的是 ( )
①通入CH4的电极为正极
②正极的电极反应式是2H2O+O2+4e-=4OH-
③通入CH4的电极反应式是CH4+2O2+4e-=CO2+2H2O
④负极的电极反应式是CH4+10OH-–8e-=CO32-+7H2O
⑤放电时溶液中的阳离子向负极移动
⑥放电时溶液中的阴离子向负极移动
A. ②④⑤ B. ②④⑥ C. ①③⑤ D. ①②③
难度: 困难查看答案及解析



