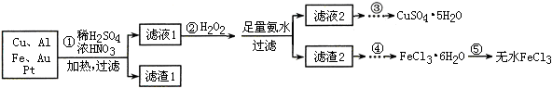
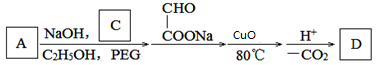
-
分枝酸可用于生化研究,其结构简式如图。下列关于分枝酸的叙述正确的是
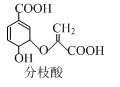
A.分子中含有2种官能团
B.可与乙醇、乙酸反应,且反应类型相同
C.1mol分枝酸最多可与3molNaOH发生中和反应
D.可使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色,且原理相同
难度: 中等查看答案及解析
-
在固态金属氧化物电解池中,高温共电解H2O—CO2混合气体制备H2和CO是一种新的能源利用方式,基本原理如图所示。下列说法不正确的是

A.X是电源的负极
B.阴极的反应式是:H2O+2e-=H2+O2-,CO2+2e-=CO+O2-
C.总反应可表示为:H2O+CO2
H2+CO+O2
D.阴、阳两极生成的气体的物质的量之比是1:1
难度: 简单查看答案及解析
-
某强酸性溶液中可能存在Al3+、Fe2+、NH4+、Ba2+、Cl﹣、CO32﹣、SO42﹣、NO3﹣中的若干种,现取适量溶液进行如下实验
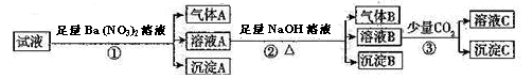
下列有关判断正确的是
A.原溶液中一定有Fe2+、SO42﹣、H+、NH4+、Al3+
B.原溶液中一定没有Ba2+、CO32﹣、NO3﹣
C.步骤③中反应的离子方程式为2AlO2﹣+CO2+3H2O=2Al(OH)3↓+CO32﹣
D.气体A、B之间肯定不能发生反应
难度: 困难查看答案及解析
-
如图是草酸溶液中H2C2O4、HC2O4-、C2O42-三种微粒的分布分数(某微粒物质的量浓度与三种微粒物质的量浓度和的比值)与pH的关系,下列有关说法不正确的是

A. pH=5 的溶液中c(C2O42-)>c(HC2O4-)
B. NaHC2O4溶液中:c(OH-)+c(C2O42-)=c(H+)+c(H2C2O4)
C. 向NaHC2O4溶液中加强酸至pH与a点对应时,溶液中 2c(Na+)=c(HC2O4-)+ c(H2C2O4)
D. 为使溶液中c(c(HC2O4-)尽可能多一些,溶液的pH最好控制在2.7左右
难度: 困难查看答案及解析
-
下列有关物质分类或归纳的说法中,正确的一组
①蔗糖和麦芽糖的化学式都可用C12H22O11表示,它们互为同分异构体
②聚乙烯、聚氯乙烯、纤维素都属于合成高分子
③明矾、石膏、冰醋酸、水都是电解质④盐酸、漂白粉、水玻璃都是混合物
⑤分馏、干馏、裂化都是化学变化 ⑥植物油、直馏汽油都可与溴水反应
A. ①③⑤ B. ②④⑥ C. ①③④ D. ②④⑤
难度: 中等查看答案及解析
-
下列实验中,所使用的装置(夹持装置略)、试剂和操作方法都正确的是

A. A B. B C. C D. D
难度: 中等查看答案及解析
-
W是由短周期元素X、Y、Z组成的盐。X、Y、Z原子的最外层电子数依次增大,Z原子最外层电子数是内层电子数的3倍;X、Y原子最外层电子数之和等于Z原子的最外层电子数;Y、Z同周期且相邻,但与X不同周期。下列说法一定正确的是
A. 三种元素的最高正化合价中,Z的最大
B. W溶液显碱性或中性
C. 原子半径:X>Y>Z
D. Y的最高价氧化物对应的水化物是强酸
难度: 中等查看答案及解析