-
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s) + 3HCl(aq)  H3CuCl4(aq)。
H3CuCl4(aq)。
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2+ + SO2 + 8Cl− + 2H2O=2CuCl43− + SO42− + 4H+
CuCl43−(aq) CuCl(s) + 3Cl−(aq)
CuCl(s) + 3Cl−(aq)

① 装置C的作用是 。
② 装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。

操作ⅱ的主要目的是 ;操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。

已知:i. CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
① D、F洗气瓶中宜盛放的试剂分别是 、 。
② 写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
-
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s) + 3HCl(aq)  H3CuCl4(aq)。
H3CuCl4(aq)。
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2+ + SO2 + 8Cl− + 2H2O=2CuCl43− + SO42− + 4H+
CuCl43−(aq) CuCl(s) + 3Cl−(aq)
CuCl(s) + 3Cl−(aq)

① 装置C的作用是 。
② 装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。

操作ⅱ的主要目的是 ;操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。

已知:i. CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
① D、F洗气瓶中宜盛放的试剂分别是 、 。
② 写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
-
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)⇌H3CuCl4(aq).
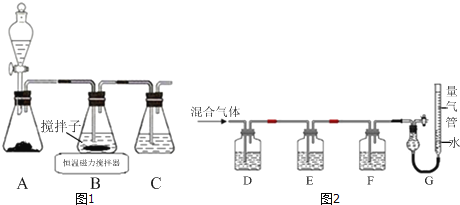
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO42-+4H+
CuCl43﹣(aq)⇌CuCl(s)+3Cl﹣(aq)

①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物



 CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
-
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)⇌H3CuCl4(aq).
(1)实验室用如图1所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl﹣+2H2O═2CuCl43﹣+SO42-+4H+
CuCl43﹣(aq)⇌CuCl(s)+3Cl﹣(aq)
①装置C的作用是_____.
②装置B中反应结束后,取出混合物进行如图所示操作,得到CuCl晶体.
混合物



 CuCl晶体
CuCl晶体
操作ⅱ的主要目的是_____
操作ⅳ中最好选用的试剂是_____.
③实验室保存新制CuCl晶体的方法是_____.
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案:_____.
(2)某同学利用如图2所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成.
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl•H2O.
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气.
①D、F洗气瓶中宜盛放的试剂分别是_____、_____.
②写出保险粉和KOH的混合溶液吸收O2的离子方程式:_____.
-
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq)  H3CuCl4(aq)。
H3CuCl4(aq)。
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl-+2H2O=2CuCl43-+SO42-+4H+
CuCl43-(aq) CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)
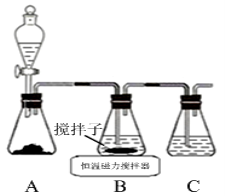
①装置C的作用是 。
②装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。

操作ⅱ的主要目的是 ;操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案: 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
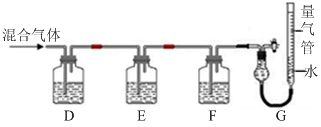
已知:i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
D、F洗气瓶中宜盛放的试剂分别是 、 。
②写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
-
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(s)+3HCl(aq) H3CuCl4(aq)。
H3CuCl4(aq)。
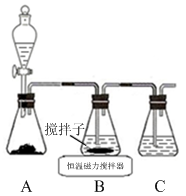
(1)实验室用下图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl-+2H2O===2CuCl43-+SO+4H+
CuCl43-(aq) CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)
①装置C的作用是 。
②装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。

操作ⅱ的主要目的是
操作ⅳ中宜选用的试剂是 。
③实验室保存新制CuCl晶体的方法是 。
④欲提纯某混有铜粉的CuCl晶体,请简述实验方案: 。
(2)某同学利用如下图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
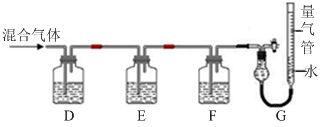
已知:
i.CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
ii.保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
①D、F洗气瓶中宜盛放的试剂分别是 、 。
②写出保险粉和KOH的混合溶液吸收O2的离子方程式: 。
-
CuCl晶体呈白色,熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水,稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4反应的化学方程式为:CuCl(s)+3HCl(aq) H3CuCl4(aq)。
H3CuCl4(aq)。
Ⅰ.实验室用图所示装置制取CuCl,反应原理为:
2Cu2++SO2+8Cl−+2H2O=2CuCl43−+SO42−+4H+
CuCl43−(aq) CuCl(s)+3Cl-(aq)
CuCl(s)+3Cl-(aq)
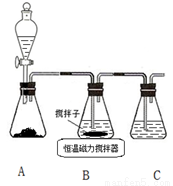
⑴装置A中分液漏斗中的试剂应该是____________。
A.稀硫酸 B.98%的硫酸 C.65%的硫酸
⑵装置B中反应结束后,取出混合物进行如下图所示操作,得到CuCl晶体。

操作ⅱ的主要目的是_______;操作ⅳ中宜选用的试剂是____________。
⑶实验室保存新制CuCl晶体的方法是___________________________。
⑷欲提纯某混有铜粉的CuCl晶体,请简述实验方案_______________。
Ⅱ.某同学利用如图所示装置,测定高炉煤气中CO、CO2、N2和O2的百分组成。
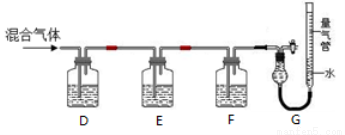
已知:①CuCl的盐酸溶液能吸收CO形成Cu(CO)Cl·H2O。
②保险粉(Na2S2O4)和KOH的混合溶液能吸收氧气。
(5)为了确保实验正确性,D、E、F、G测定气体顺序应该为________________。
(6)写出保险粉和KOH的混合溶液吸收O2的离子方程式__________________。
-
亚铜的化合物经常具有令人惊奇的化学性质,常见的有CuH、CuCl等。
已知:CuCl熔点为430℃,沸点为1490℃,见光分解,露置于潮湿空气中易被氧化,难溶于水、稀盐酸、乙醇,易溶于浓盐酸生成H3CuCl4,反应的化学方程式为CuCl(白色,s)+3HCl(aq) H3CuCl4(黄色,aq)。经常有两种方法制CuCl:
H3CuCl4(黄色,aq)。经常有两种方法制CuCl:
方法1:次磷酸H3PO2 是一种强还原剂,将它加入CuSO4水溶液,加热到40~50℃,析出一种红棕色的难溶物CuH。待CuH生成后将A装置产生的HCl气体通入,可产生CuCl。

(1)写出H3PO2与CuSO4水溶液反应的化学方程式____________________。
(2)A装置中分液漏斗与圆底烧瓶中的物质依次为_________________________。
(3)刚开始通HCl气体时B装置中反应的化学方程式为______________________________。
(4)请描述从开始通HCl气体到通大量HCl气体过程中B装置中的观象_______________。
方法2:实验室用也可用如图所示装置制取CuCl,反应原理为:2Cu2++SO2+8Cl-+2H2O=2CuCl43-+SO42-+4H+
CuCl43-(aq) CuCl(s)+3C1-(aq)
CuCl(s)+3C1-(aq)
装置B中反应结束后,取出混合物进行一系列操作可得到CuCl晶体。
(5)①在反应过程中SO2要过量通入的原因是______________________。
②欲提纯某混有铜粉的CuCl晶体,请简述实验方案:___________________。
-
氯化亚铜是重要的铜盐系列化工产品,广泛应用于石油化工、有机合成等行业。CuCl晶体呈白色,微溶于水,不溶于稀盐酸和乙醇,露置于潮湿空气中易水解氧化为绿色的[Cu 2(OH)3C1],见光易分解。某研究小组以CuCl2(含少量Fe2+)粗品为原料制取CuCl,设计的合成路线如下:
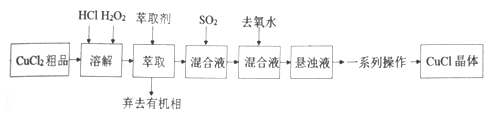
己知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮。
②CuCl在溶液中存在:CuCl(s)+2Cl-(aq) [CuCl3]2-(aq)。
[CuCl3]2-(aq)。
请回答:
(1)下列叙述正确的是__________。
A.CuCl2原料中含有的Fe2+等杂质经氧化、萃取几乎都在有机相中被除去
B.加入萃取剂后,混合物转移至分液漏斗中,塞上玻璃塞,如图用力振摇
C.经几次振摇并放气后,手持分液漏斗静置待液体分层
D.用浓盐酸洗涤分液后的有机相时,需在分液漏斗中进行
(2)上述合成路线中,SO2通入混合液的实验装置如下图所示:
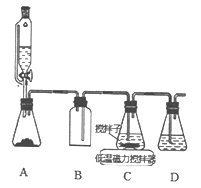
①装置D的作用是_______________。
②C中反应的离子方程式为_____________。
(3)上述合成路线中,向混合液中加入大量去氧水的目的是________________。
(4)上述合成路线中,一系列操作包括:抽滤、洗涤、干燥。干燥时应注意密封、____________。
(5)现称取l.200g产品,用硫酸酸化的硫酸铁溶解,并稀释成250mL。每次用移液管移取25.00mL溶液于锥形瓶中,用0.01000,mol·L-1KmnO4溶液滴定平均消耗24.00mL。
①用移液管吸取25.00mL溶液后,把溶液转移到锥形瓶中的具体操作为____________。
②产品中CuCl的纯度为__________(本实验条件下,Cl-难于被MnO4-氧化)。
-
CuCl 晶体微溶于水和稀硫酸,不溶于乙醇,但易溶于浓盐酸和氯化铵溶液,发生的反应为:CuCl+Cl- CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
CuC12,且其见光易分解,露置于潮湿空气中易被氧化。回答下列问题:
(1)实验室保存新制CuCl 晶体的方法是__________。
(2)向硫酸铜溶液中加入亚硫酸铵和氯化铵,会发生反应生成CuCl。
①该反应的离子方程式为_____________。
②(NH4)2SO3 要适当过量,目的为保证Cu2+的还原速率、_____________。
③已知Cu2+ 的沉淀率与NH4Cl、CuSO4的物质的量之比[n(NH4Cl)/n(CuSO4)]的关系如图甲所示,当氯化铵用量增加到一定程度后,Cu2+的沉淀率减小,原因是_______________。

(3)已知:CuCl 固体、CuOH 固体分别为白色和橙黄色,且Ksp(CuCl)= 1.2×10-6,Ksp(CuOH)=1.2×10-14。用铜电极电解饱和食盐水的装置如图乙所示,阳极的电极反应式为Cu-e-+Cl -=CuCl。则实验过程中的实验现象为_________________。
H3CuCl4(aq)。
CuCl(s) + 3Cl−(aq)




















