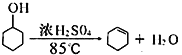-
化学与生活、生产密切相关,下列说法正确的是
A. 饮用矿泉水瓶的主要成分是聚氯乙烯
B. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
C. 我国预计2020 年发射的首颗火星探测器中太阳能电池帆板的材料是二氧化硅
D. 《本草经集注》中关于鉴别硝石(KNO3) 和朴硝(Na2SO4) 的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
难度: 简单查看答案及解析
-
下列说法正确的是
A. H、D、T属于同位素,H2、D2、T2属于同素异形体
B. 氯水、王水是混合物,铁粉、漂白粉是纯净物
C. HCl、NH3、BaSO4是电解质,CO2、Cl2、C2H5OH 是非电解质
D. 风能、生物质能是可再生能源,煤、石油、天然气是不可再生能源
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A. 常溫常压下,36g18O2中所含的中子数为16NA
B. 4.6 gNO2与N2O4的混合气体中所含氮原子数为0.1 NA
C. 标准状况下,2.24 L 苯含有的分子数等于0.1 NA
D. 在过氧化钠与水的反应中,每消耗0.1mol过氧化钠,转移电子的数目为0.2 NA
难度: 中等查看答案及解析
-
下列有关物质的性质与用途具有对应关系的是
A. 浓硫酸具有脱水性,可用于干燥气体
B. 铝具有良好导热性,可用铝罐贮运浓硝酸
C. 维生素C具有还原性,能帮助人体将Fe3+转化为易吸收的Fe2+
D. FeCl3溶液具有酸性,可用作铜制线路板的蚀刻剂
难度: 中等查看答案及解析
-
下列生活中的现象与氧化还原反应知识无关的是
A. 烧菜用过的铁锅,放置后常出现红棕色斑迹
B. 用热的纯碱溶液清洗油污
C. 用酸性重铬酸钾检验司机是否酒后驾车
D. 用新制的氢氧化铜悬浊液与病人的尿液混和加热,来检验病人是否患糖尿病
难度: 中等查看答案及解析
-
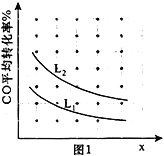
2017 年5月4 日《光明日报》报道称,中科院大连化学物理研究所的研究团队利用多功能催化剂首次实现了CO2直接加氢制汽油的过程。其转化过程如图所示:
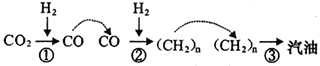
下列说法正确的是
A. 反应①的产物中含有水。
B. 反应②为化合反应
C. 所制得汽油的主要成分是烃和烃的含氧衍生物
D. 这种人造汽油用作汽车的燃料时,汽车尾气中不含氮氧化物
难度: 中等查看答案及解析
-
下列反应中属于取代反应的是
A. 甲苯使酸性高锰酸钾溶液褪色 B. 乙烯与溴的四氯化碳溶液反应
C. 苯与浓硝酸和浓硫酸的混合液加热反应 D. 在苯中滴入溴水,溴水层变为无色
难度: 中等查看答案及解析
-
下列说法正确的是
A. 丙烯分子中所有原子均在同一平面上
B.
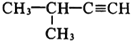 命名为2-甲基-3-丁炔
命名为2-甲基-3-丁炔C. 化合物
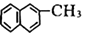 不是苯的同系物
不是苯的同系物D. C5H12的同分异构体数目与甲苯的一氯代物数目相同
难度: 中等查看答案及解析
-
某反应过程能量变化如图所示,下列说法正确的是
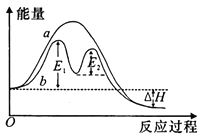
A. 反应过程a有催化剂参与
B. 该反应为放热反应,热效应等于△H
C. 改变催化剂,不能改变该反应的活化能
D. 有催化剂条件下,反应的活化能等于E1+E2
难度: 中等查看答案及解析
-
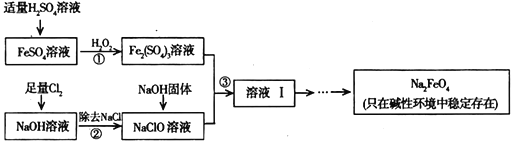
CuSO4是一种重要的化工原料,其有关制备途径如图所示。下列说法正确的是
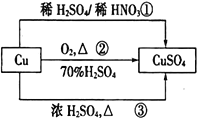
A. 途径①所用混酸中H2SO4与HNO3物质的量之比最好为2∶3
B. 利用途径③制备16g硫酸铜,消耗硫酸的物质的量为0.1mol
C. 生成等量的硫酸铜,三个途径中参加反应的硫酸的物质的量:①=②=③
D. 与途径①、③相比,途径②更好地体现了绿色化学思想
难度: 中等查看答案及解析
-
下列有关实验原理或操作正确的是
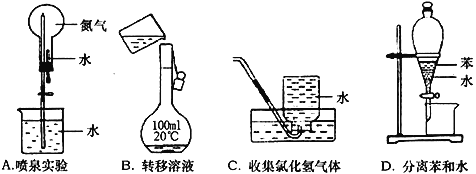
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列化学过程及其表述正确的是
A. 向NaHSO4溶液中滴入Ba (OH)2溶液至中性:H++SO42-+Ba2++OH-=BaSO4 ↓+H2O
B. 由水电离的c (H+) 为10-13mol·L-l 的溶液中;Na+、NO3-、SO32-、Cl-一定能大量共存
C. 可以用硫氰化钾溶液来检验FeCl2溶液中的溶质是否被氧化
D. 可以用浓盐酸酸化的KMnO4溶液与H2O2混合,证明H2O2 具有还原性
难度: 困难查看答案及解析
-
如右图所示,将铁棒和石墨棒插入盛有饱和NaCl溶液的U型管中。下列分析正确的是( )
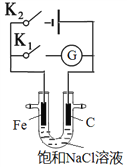
A. K1闭合,铁棒上发生的反应为2H++2e-→H2↑
B. K1闭合,石墨棒周围溶液pH逐渐升高
C. K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法
D. K2闭合,电路中通过0.002NA个电子时,两极共产生0.001mol气体
难度: 困难查看答案及解析
-
用0.1000mol·L-1NaOH 标准溶液滴定未知浓度的盐酸溶液恰好滴定至终点,下列说法正确的是
A. 配制450mL0.1000mol·L-1的NaOH 溶液时,需用托盘天平称取NaOH 固体1.8 g
B. 滴定前准备工作中滴定管一般需要进行操作:查漏→洗涤→装液→调液面→记录
C. 若选用酚酞作指示剂,到达滴定终点时,锥形瓶内液体恰好褪色
D. 读取NaOH 溶液体积时,滴定前读数正确,滴定后俯视读数,则所测盐酸的浓度数值将偏低
难度: 中等查看答案及解析
-
水的电离平衡曲线如右图所示,下列说法中,正确的是

A. 图中A、B、D三点处KW间的关系: B>A>D
B. 100℃,向pH=2的稀硫酸中逐滴加入等体积pH=10的稀氨水,溶液中 c(NH4+)/c(NH3·H2O)减小,充分反应后,溶液到达B点
C. 温度不变,在水中加入适量NH4Cl固体,可从A点变化到C点
D. 加热浓缩A点所示溶液,可从A点变化到B点
难度: 中等查看答案及解析
-
在AgC1悬浊液中存在平衡: AgCl (s)
Ag+(aq)+Cl-(aq)。已知常温下,Ksp (AgCl)=1.6×10-10 (mol/L)2。下列叙述正确的是
A. 常温下,AgCl 悬浊液中c (C1-)= 4×10-5.5mol/L
B. 温度不变时,向AgCl 悬浊液中加入少量NaCl 粉末,平衡向左移动,Ksp减小
C. 向AgCl悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl) sp(AgBr)
D. 常温下,将0.001 mol·L-1AgNO3溶液与0.001 mol·L-1的KCl 溶液等体积混合,无沉淀析出
难度: 中等查看答案及解析