-
水是生命之源,它与我们的生活密切相关。自来水厂常用高铁酸钠(Na2FeO4)改善水质。高铁酸钠具有很强的氧化性,是一种新型的绿色净水消毒剂,在工业上制备高铁酸钠的方法有多种。
(1)简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_________________________________________________________________________。
(2)干法制备高铁酸钠的反应原理如下:
2FeSO4+6Na2O2==aNa2FeO4+bM↑+2Na2O+2Na2SO4
①高铁酸钠中铁元素的化合价为________________。
②上述方程式中b=____。每生成1molM,该反应转移电子的物质的量为_____________mol。
(3)工业上可以通过次氯酸钠氧化法制备高铁酸钠,生产过程如下:
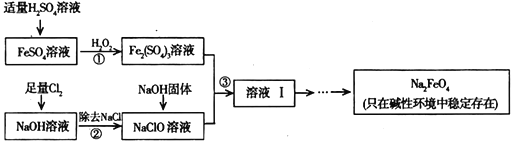
①步骤③中除生成Na2FeO4外,还有副产品Na2SO4、NaCl,则步骤③中反应的离子方程式为____________________________________。
②己知Na2FeO4在强碱性溶液中的溶解度较小。可向Na2FeO4溶液中继续加入氢氧化钠固体得到悬浊液。从Na2FeO4悬浊液得到固体的操作名称为_____________________。
(4)计算Na2FeO4的消毒效率(以单位质量得到的电子数表示)约是氯气的_______倍(结果保留两位小数。)
-
(15分)铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理___________。
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
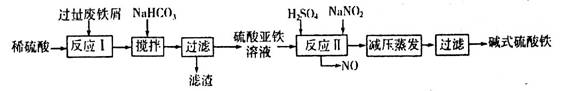
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:

回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
-
铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理______.
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
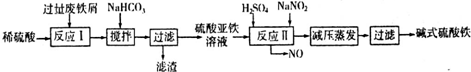
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
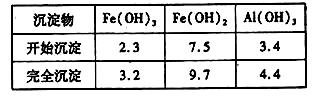
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式______.
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为______.
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为______g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为______.
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式______.
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式______.
-
铁及其化合物在日常生活、生产中应用广泛。研究铁及其化合物的应用意义重大。
I.水体的净化和污水的处理与铁及其化合物密切相关。
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质。简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理_______________。
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血。工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
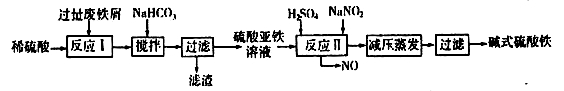
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
回答下列问题:
①写出反应I中发生的氧化还原反应的离子方程式___________。
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为____________。
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为____________g。
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子。该水解反应的离子方程式为___________。
II铁的化合物也是制备高能锂电池的重要原料。已知磷酸亚铁锂电池总反应为:
FePO4+Li LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
LiFePO4,电池中的固体电解质可传导Li+。试写出该电池充电时的阳极反应式____________。常温下以该电池为电源电解200mL饱和食盐水,当消耗1.4g Li时,溶液的pH为____________。(忽略溶液的体积变化)。
-
铁及其化合物在日常生活、生产中应用广泛.研究铁及其化合物的应用意义重大.
I.水体的净化和污水的处理与铁及其化合物密切相关.
(1)自来水厂常用高铁酸钠(Na2FeO4)改善水质.简述高铁酸钠用于杀菌消毒同时又起到净水作用的原理 .
(2)碱式硫酸铁[Fe(OH)SO4]是一种用于污水处理的新型高效絮凝剂,在医药上也可用于治疗消化性溃疡出血.工业上利用废铁屑(含少量氧化铝、氧化铁等)生产碱式硫酸铁的工艺流程如下:
已知:部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 |
| 开始沉淀 | 2.3 | 7.5 | 3.4 |
| 完全沉淀 | 3.2 | 9.7 | 4.4 |
回答下列问题:
①写出反应I中主要发生的氧化还原反应的离子方程式 ________ .
②加入少量NaHCO3的目的是调节溶液pH,应控制pH的范围为 ________ .
③在实际生产中,反应II常同时通入O2以减少NaNO2的用量,若通入5.6L O2(标准状况),则相当于节约NaNO2的质量为 ________ g.
④碱式硫酸铁溶于水后产生的[Fe(OH)]2+离子,可部分水解生成[Fe2(OH)4]2+聚合离子.该水解反应的离子方程式为 .
II铁的化合物也是制备高能锂电池的重要原料.已知磷酸亚铁锂电池总反应为:FePO4+Li LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 ________ .
LiFePO4,电池中的固体电解质可传导Li+.试写出该电池充电时的阳极反应式 ________ .
-
化学与生产、生活、社会密切相关,下列有关说法中正确的是( )
A.Na2FeO4有强氧化性,还原产物又易水解成胶体,是自来水理想的消毒剂和净水剂
B.玻璃中含有的SiO2可与NaOH溶液反应,故常用NaOH溶液雕刻玻璃纹饰
C.硅酸盐Na2Fe2Si3O9用氧化物的形式可表示为2FeO • Na2O • 3SiO2
D.面粉中禁止添加CaO2、过氧化苯甲酰等增白剂,CaO2属于碱性氧化物,也属于离子化合物,其阴阳离子个数比为2 : l,过氧化苯甲酞属于有机物
-
化学与人类生产、生活、社会可持续发展密切相关。下列说法正确的是( )
A.自来水厂常用明矾作消毒杀菌剂
B.高铁车用大部分材料是铝合金,铝合金材料具有强度大、质量轻、抗腐蚀能力强等优点
C.硅胶可作瓶装药品的干燥剂及催化剂载体,也是重要的半导体材料
D.使用肥皂洗手可预防病毒,肥皂的主要成分硬脂酸钠溶于水显酸性
-
(6分)水是生命之源,它与我们的生活密切相关。在化学实验中,水也是一种常用的试剂。
(1)水分子与H+形成水合氢离子( H3O + )的立体构型为________。
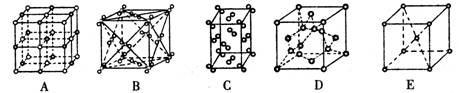
(2)冰是立方面心结构。下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞示意图(未按顺序排序)。上述五种晶体中与冰的晶体类型相同的是________;(填写编号)。
(3) 在冰的晶体中,每个水分子与相邻的 4 个水分子形成氢键(如图所示),
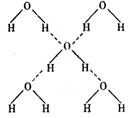
已知冰的升华热(即 1 mol 水由冰转化为水蒸汽所需能量)是51KJ/mol,除氢键外,水分子间还存在范德华力(11 kJ / mol ) , 则冰晶体中氢键的“键能”(破坏 lmd 氢键所需的能量即为氢键的“键能”)是________KJ kJ / mol 。
-
(1)水是生命之源,它与我们的生活密切相关.在化学实验和科学研究中,水也是一种常用的试剂.水分子在特定条件下容易得到一个H+,形成水合氢离子(H3O+).下列对上述过程的描述不合理的是(________ )
A.水分子中原氧原子与氢原子之间的化学键发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(2)随着人类对水的研究的不断深入,水的应用也越来越广泛.研究人员最近发现,在一定的实验条件下,给水施加一个弱电场,在20℃、1个大气压下,水可以结成冰,称为“热冰”.“热冰”有许多实用价值,如开发新药、用于纳米打印机等,还可能用来________(填写序号)
A.代替干冰 B.防止冰川熔化 C.在室温下制作冰雕 D.建室温溜冰场
(3)在灾害性事故中,骨折时有发生,通常用石膏来固定骨折部位.石膏可分为熟石膏和生石膏两种,医生使用的石膏是________(填分子式或名称).石膏定型时发生的化学反应方程式________.
(4)火星探测车在火星大气中检测到了气体A.资料显示,A分子是三原子分子,其相对分子质量为60,在地球环境下A易分解.粉未状的KSCN与浓硫酸在一定条件下可得到气体A和二种硫酸氢盐,生成物的物质的量之比是1:1:1.则气体A的结构式是________.
(5)新型离子化合物[HC60]+[CB11H60Cl60]-是一种功能材料.它可以用超酸H(CB11H60Cl60)和C60反应,使C60得到质子来制取.该反应类型跟中学课本中的一个化学反应类似,课本中的这个反应是(写一个化学方程式)________.
-
(8分,每空2分)水是生命之源,它与我们的生活密切相关。在化学实验和科学研究中,水也是一种常用的试剂。
(1)写出与H2O分子互为等电子体的微粒______________(填1种)。
(2)水分子在特定条件下容易得到一个H+,形成水合氢原子(H3O+)。下列对上述过程的描述不合理的是 ( )
A.氧原子的杂化类型发生了改变 B.微粒的形状发生了改变
C.微粒的化学性质发生了改变 D.微粒中的键角发生了改变
(3)下列是钠、碘、金刚石、干冰、氯化钠晶体的晶胞图(未按顺序排序)。与冰的晶体类型相同的是________(请用相应的编号填写)。

(4)在冰晶体中,每个水分子与相邻的4个水分子形成氢键(如下图所示),已知冰的升华热是51 kg/mol,除氢键外,水分子间还存在范德华力(11 kJ/mol),则冰晶体中氢键的“键能”是________kJ/mol;










