-
下列仪器常用于物质分离的是
①漏斗 ②试管 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥研钵.
A.①③④ B.①②⑥ C.①③⑤ D.①③⑥
难度: 简单查看答案及解析
-
胶体的最本质的特征是
A.丁达尔效应
B.可以通过滤纸
C.布朗运动
D.分散质颗粒的直径在1nm~100nm之间
难度: 简单查看答案及解析
-
下列关于金属的叙述中正确的是
A.所有的金属都是固态的
B.金属具有导电性、导热性和延展性
C.金属都能与酸反应,但不能与碱反应
D.金属元素在自然界中都是以化合态存在的
难度: 简单查看答案及解析
-
下列关于“焰色反应”的理解正确的是
A.只有金属单质才有焰色反应
B.只有金属化合物才有焰色反应
C.只有某些金属或其化合物才有焰色反应
D.只有金属离子才有焰色反应
难度: 简单查看答案及解析
-
下列说法正确的是
A.合金是指由几种金属熔合而成的具有一定金属特性的物质
B.光导纤维的主要成分是晶体硅
C.硅石、石英、水晶、玛瑙中都含有二氧化硅
D.明矾净水是因为其具有杀菌消毒的性质
难度: 简单查看答案及解析
-
下列表格中各项分类都正确的一组是
类别
选项
纯净物
混合物
电解质
非电解质
A
生理盐水
明矾
液态KNO3
蔗糖
B
CaO
海水
铜
乙醇
C
胆矾
铝合金
AgCl
CO2
D
氢氧化钠
空气
Na2SO4溶液
食醋
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
下列说法正确的是
A.元素的单质一定是由还原该元素的化合物来制得
B.含有最高价元素的化合物不一定具有很强的氧化性
C.阳离子只能得到电子被还原,阴离子只能失去电子被氧化
D.在化学反应中,得电子越多的氧化剂,其氧化性就越强
难度: 中等查看答案及解析
-
下列物质的用途中,不正确的是
A.纯碱:制玻璃
B.烧碱:治疗胃酸过多的一种药剂
C.过氧化钠:制氧气
D.小苏打:发酵粉主要成份
难度: 简单查看答案及解析
-
在10﹣9m~lO﹣7m范围内,对原子、分子进行操纵的纳米超分子技术往往能实现意想不到的变化.如纳米铜颗粒一遇到空气就会剧烈燃烧,甚至发生爆炸.下列说法正确的是
A.纳米铜是一种新型化合物
B.纳米铜颗粒比普通铜更易与氧气发生反应
C.纳米铜与普通铜所含铜原子的种类不同
D.纳米铜无需密封保存
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数,下面叙述正确的是
A.标准状况下,11.2L CCl4所含分子数为0.5NA
B.1L 1mol/L的氯化钠溶液中,所含离子数为NA
C.常温下,4.4g CO2和N2O(不反应)混合物中所含有的原子数为0.3NA
D.1mol Cl2与足量的铁发生反应,转移的电子总数为3NA
难度: 困难查看答案及解析
-
已知2MOyx﹣+5S2﹣+16H+=2M2++5S↓+8H2O,则MOyx﹣中的M的化合价为
A.+3 B.+4 C.+6 D.+7
难度: 中等查看答案及解析
-
如图表示在某溶液中滴加Ba(OH)2溶液时,沉淀的物质的量随Ba(OH)2的物质的量的变化关系.该溶液的成分可能是
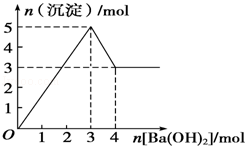
A.MgSO4 B.KAl(SO4)2 C.Al2(SO4)3 D.NaAlO2
难度: 困难查看答案及解析
-
将一定量的铁片和浓硫酸混合加热,充分应后得到溶液X,X中除Fe3+外还可能含有Fe2+.若要确认其中的Fe2+,应选用
A.KSCN溶液和氯水
B.铁粉和KSCN溶液
C.浓氨水
D.酸性KMnO4溶液
难度: 中等查看答案及解析
-
把过氧化钠投入含有HCO3﹣、Cl﹣、Mg2+、Na+的水溶液中,离子数目不变的是
A.HCO3﹣ B.Cl﹣ C.Mg2+ D.Na+
难度: 中等查看答案及解析
-
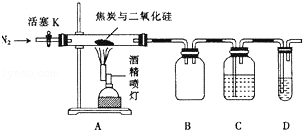
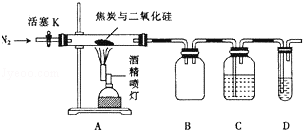
下列制备和收集气体的实验装置合理的是
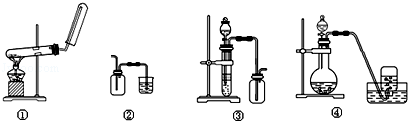
A.装置①:用氯化铵和氢氧化钙制NH3
B.装置②:收集NO气体
C.装置③:用锌粒和稀硫酸制H2
D.装置④:用双氧水和二氧化锰制O2
难度: 中等查看答案及解析
-
氮化铝(AlN)是一种新型无机材料,广泛应用于电子、陶瓷等工业领域.在一定条件下,AlN可通过反应Al2O3+N2+3C
2AlN+3CO合成.已知AlN可与NaOH溶液反应放出有刺激性气味的气体.下列叙述正确的是
A.上述反应中,N2是还原剂,Al2O3是氧化剂
B.上述反应中,每生成1molAlN需转移6mol电子
C.AlN属于离子化合物,其中氮元素的化合价为+3
D.AlN与NaOH溶液反应的化学方程式为:AlN+NaOH+H2O═NaAlO2+NH3↑
难度: 困难查看答案及解析
-
已知在热的碱性溶液中,NaClO发生如下反应:3NaClO=2NaCl+NaClO3,在相同条件下NaClO2也能发生类似的反应,其最终产物是
A.NaCl、NaClO
B.NaCl、NaClO3
C.NaClO、NaClO3
D.NaClO3、NaClO4
难度: 简单查看答案及解析
-
以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
氧化物
环境问题
主要来源
A
CO2
酸雨
化石燃料的燃烧
B
SO2
光化学烟雾
汽车尾气的排放
C
NO2
温室效应
工厂废气的排放
D
CO
煤气中毒
煤炭的不完全燃烧
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
将NO2、NH3、O2混合气22.4L通过稀硫酸后,溶液质量增加了26.7g,气体体积缩小为4.48L(气体均在标准状况下测定)剩余气体能使带火星的木条着火,则混合气体的平均相对分子质量为
A.30.1 B.31.1 C.32.1 D.33.1
难度: 困难查看答案及解析
-
Cl2、HCl的混合气体通入足量的NaOH溶液中,充分反应后,溶液中除大量OH﹣外,还有Cl﹣、ClO﹣、ClO3﹣,且这三种离子的物质的量之比为9:2:1,则原混合气体中Cl2和HCl体积之比为
A.5:2 B.2:5 C.3:1 D.1:3
难度: 困难查看答案及解析
-
现有Na2CO3、H2SO4、Ba(OH)2三种物质的物质的量浓度与体积都相等的溶液,若以不同顺序将它们中的两种混合起来,出现沉淀后过滤,再将滤液与第三种溶液混合起来,最终所得的溶液
A.一定呈酸性
B.不可能呈碱性
C.可能呈中性或碱性
D.一定呈中性
难度: 中等查看答案及解析
-
把500mLNH4HCO3和Na2CO3的混合溶液分成五等份,取一份加入含a mol氢氧化钠的溶液恰好反应完全,另取一份加入含b mol HCl的盐酸恰好反应完全,则该混合溶液中c(Na+)为
A.
B.(2b﹣a)mol/L C.
D.(10b﹣5a)mol/L
难度: 困难查看答案及解析
-
下列实验“操作和现象”与“结论”都正确的是
操作和现象
结论
A
切开金属钠,钠表面的银白色会逐渐褪去
Na在空气中会生成Na2O2
B
向某溶液中滴加BaCl2溶液,出现白色沉淀,再加足量稀HCl,若白色沉淀不溶解
原溶液中一定含SO42﹣
C
向Fe(NO3)2溶液中滴加稀硫酸和KSCN溶液,变成红色
溶液中有Fe3+生成
D
将FeCl2溶液滴加到少许酸性KMnO4溶液中,溶液褪色
FeCl2具有漂白性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
向mg镁和铝的混合物重加入适量的稀硫酸,恰好完全反应生成标准状况下的气体bL.向反应后的溶液中加入cmol/L氢氧化钾溶液VmL,使金属离子刚好沉淀完全,得到的沉淀质量为ng.再将得到的沉淀灼烧至质量不再改变为止,得到固体pg.则下列关系不正确的是
A.c=
B.p=m+
C.n=m+17Vc D.
m<p<
m
难度: 极难查看答案及解析