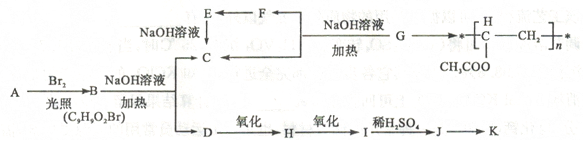
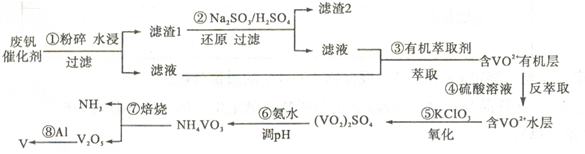
-
芥子气[(ClCH2CH2)2S是一种毒气,即使嗅觉不能感受的极低浓度也会对人造成伤害,可用NaOH溶液解毒。芥子气可用以下方法制备 2CH2=CH2+S2Cl2→(ClCH2CH2)2S+S下列有关说法正确的是
A.芥子气是直线型分子 B.S2Cl2中有极性键和非极性键
C.制备反应中S2Cl2,作还原剂 D.NaOH溶液解毒原理是中和反应
难度: 简单查看答案及解析
-
室温下,下列各组粒子在指定溶液中能大量共存的是
A.Ba(NO3)2 溶液中:SO2、Na+、NH4+、CH3COO-
B.Kw/c(H+)=0.1mol/L的溶液中:K+、Ba2+、C1-、HCO—
C.FeCl2溶液中:H2O2、Mg2+、H+、Cl-
D.含苯酚的水溶液中用::Al3+、NH4+、Br-、SO42-
难度: 中等查看答案及解析
-
下列有关实验设计或操作、观察或记录、结论或解释都正确的是
实验设计或操作
观察或记录
结论或解释
A
将少量浓硝酸分多次加入Cu和稀硫酸的混合液中
产生红棕色气体
硝酸的还原产物是NO2
B
某粉末用酒精润湿后,用铂丝蘸取做焰色反应
火焰呈黄色
该粉末一定不含钾盐
C
在A1C13 和MgCl2 的混合液中加入过量NaOH溶液
先生成白色沉淀,后沉淀部分溶解
金属性Na>Mg>Al
D
将盛水的分液漏斗先静置,再倒置
漏斗口和活塞不渗水
分液漏斗不漏液
难度: 简单查看答案及解析
-
下列物质的转化在一定条件下通过一步反应难以实现的是
A.Ca(ClO) 2(aq)→HClO(aq)→HCl(aq)
B.FeO →FeCl2(aq)→FeCl3(aq)→无水FeCl3
C.Al2O3→NaAlO2(aq)→Al(OH)3
D.H2SiO3→SiO2→SiF4
难度: 中等查看答案及解析
-
将H2S通入FeCl3 溶液中,过滤后将反应液加入电解槽中电解(如下图所示)电解后的溶液还可以循环利用。该方法可用于处理石油炼制过程中产生的H2S废气。
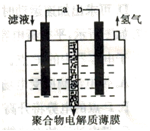
下列有关说法正确的是
A.过滤得到的沉淀可能是FeS和S
B.若有0.20mol的电子转移,一定能得到2.24L的氢气
C.可以用Fe与外接电源的a极相连
D.与a极相连的电极反应为Fe2+-2e-=Fe3+
难度: 中等查看答案及解析
-
纳米钴(Co)加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g)
CH4(g)+H2O(g) △H<0。有关说法正确的是
A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变
B.缩小容器体积,平衡向正反应方向移动CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分H2O(g)能加快正反应速率
难度: 简单查看答案及解析
-
25 ℃在25 ml、C1 mol/L的一元弱酸(HA)中,加人们v2 mL、0.1mol/L的一元强碱 (BOH)。下列有关判断十定正确的是
A.当25Cl=0.1V2时,c(A—)>c(B—) B.当pH>7时,c(A—)>c(OH—)。
C.当pH=7,且V2=25 时,C1>0.1 D.当pH<7 时,c(B+)>c(A-)
难度: 中等查看答案及解析