-
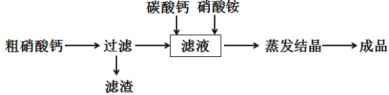
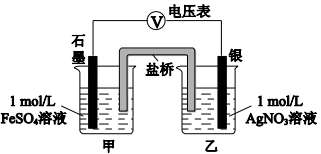
下列装置中,将电能转化为化学能的是

难度: 简单查看答案及解析
-
下列说法正确的是
A.除去苯甲酸中少量不溶性杂质和可溶性杂质,可采取分液的方法
B.乙炔、苯和乙苯的实验式相同
C.可用溴水鉴别乙醇、甲苯和溴苯
D.有机物
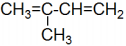 的系统命名为2-甲基-1,3-二丁烯
的系统命名为2-甲基-1,3-二丁烯难度: 中等查看答案及解析
-
下列溶液中离子或分子有可能大量共存的是
A.由水电离出的c(H )=10-13mol/L 溶液:Mg2+、Cu2+、SO42-、NO3-
B.无色溶液中:Na+、NH4+、Cl-、S2-
C.高锰酸钾溶液:Fe3+、H+、SO42-、C2H5OH
D.中性溶液中:Fe3+、K+ 、Cl-、SO42-
难度: 中等查看答案及解析
-
下列说法正确的是
A.丙烷的比例模型是

B.
 与
与 互为同系物
互为同系物C.
 属于芳香烃
属于芳香烃D.羟基的电子式为
,1 mol -OH 含有7 mol 电子
难度: 简单查看答案及解析
-
下列说法中正确的是
A.分子式为C5H10的有机化合物全都能使溴水褪色
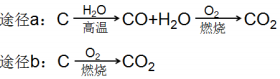
B.相同条件下,等质量的碳按a、b 两种途径完全转化,途径a 比途径b 放出更多热能
C.淀粉和纤维素水解的最终水解产物相同
D.若H2O2分解产生1molO2,理论上转移的电子数约为4×6.02×1023
难度: 中等查看答案及解析
-
下列实验设计及其对应的离子方程式均正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B.用FeCl3溶液腐蚀铜来制作印刷电路板:2Fe3+ + Cu =2Fe2++Cu2+
C.向Na2SiO3溶液中通入过量SO2:SiO32-+ SO2+ H2O =H2SiO3↓+SO32-
D.向Al 2(SO4)3溶液中加入过量的NH3·H2O:Al3++4NH3·H2O =AlO2-+4NH4++2H2O
难度: 中等查看答案及解析
-
室温下,有如下三种溶液:①CH3COOH、②NaOH、③CH3COONa,下列说法正确的是
A.将pH=3 的①溶液与pH=11的②溶液等体积混合,溶液pH>7
B.若三种溶液浓度相同,将溶液①、②等体积混合,混合液中c(CH3COO-)等于溶液③中的c(CH3COO-)
C.将①、②等浓度体积混合,混合液中c(CH3COO-) +c(CH3COOH) = c(Na+)
D.若②、③的pH值相同,则两种溶液中水的电离程度相同
难度: 中等查看答案及解析
-
2015 年10 月,中国本土科学家屠呦呦因发现青蒿素(见右图)获得诺贝尔生理学或医学奖。青蒿素是继乙氨嘧啶、氯喹、伯喹之后最有效的抗疟特效药,具有速效和低毒的特点,曾被世界卫生组织称做是“世界上唯一有效的疟疾治疗药物”。下列关于青蒿素的说法正确的是
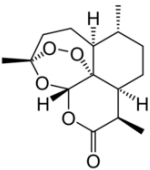
A.青蒿素的分子式是C15H24O5 B.青蒿素易溶于水
C.青蒿素能与NaOH 反应 D.青蒿素容易与H2发生加成反应
难度: 中等查看答案及解析
-
中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是
选项
规律
结论
A
溶解度小的沉淀易向溶解度更小的沉淀转化
ZnS 沉淀中滴加CuSO4 溶液可以得到CuS 沉淀
B
较强酸可以制取较弱酸
次氯酸溶液无法制取盐酸
C
反应物浓度越大,反应速率越快
常温下,相同的铝片中分别加入足量的浓、稀硝酸,浓硝酸中铝片先溶解完
D
结构和组成相似的物质,沸点随相对分子质量增大而升高
NH3 的沸点低于PH3
难度: 困难查看答案及解析
-
X、Y、Z 均为短周期元素,X、Y 处于同一周期,X、Z 的最低价离子分别为X2-和Z-,Y+和Z-具有相同的电子层结构。下列说法正确的是
A.气态氢化物的稳定性:HX>HZ B.原子半径:Y> X>Z
C.离子半径:X2->Y+>Z- D.元素的最高化合价:Z>X> Y
难度: 中等查看答案及解析
-
下述实验方案能达到实验目的是
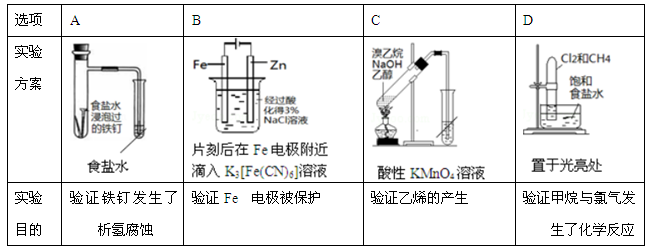
难度: 困难查看答案及解析
-
某模拟“人工树叶”电化学实验装置如右图所示,该装置能将 H2O 和 CO2转化为O2和燃料(C3H8O)。下列说法正确的是

A.该装置将化学能转化为光能和电能
B.该装置工作时,H+从a 极区向b 极区迁移
C.每有44 g CO2被还原,则生成标准状况下 33.6 L O2
D.a电极的反应为:3CO2+ 16H+-18e-=C3H8O+4H2O
难度: 困难查看答案及解析
-
常温下,将Cl2缓慢通入水中至饱和,然后向所得饱和氯水中滴加0.1mol•L﹣1 的NaOH 溶液,整个实验进程中溶液的pH 变化曲线如图所示,下列叙述正确的是

A.向a点所示溶液中通入SO2,溶液的酸性和漂白性均增强
B.b点所示的溶液中:c(H+)>c(Cl-)>c(ClO-)>c(HClO)
C.由a点到b点的过程中,溶液中
减小
D.c点所示溶液中:c(Na+)=2c(ClO﹣)+c(HClO)
难度: 困难查看答案及解析
-
在恒容密闭容器中通入X 并发生反应:2X(g)
Y(g) ,温度T1、T2下X 的物质的量浓度c(X)随时间t 变化的曲线如图所示,下列叙述正确的是
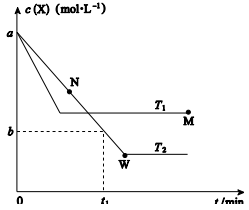
A.该反应进行到M点放出的热量大于进行到W点放出的热量
B.T2下,在0~t1时间内,v(Y)=
mol·L-1·min-1
C.M点的平衡常数小于W点的平衡常数
D.M点时再加入一定量X,平衡后X的转化率减小
难度: 困难查看答案及解析