-
日本地震导致核电站泄露出大量的人工放射性核素,如
(碘)、
(铯)等。下列说法正确的是( )
A.
与
为不同的核素,但具有相同的化学性质
B.
是碘元素稳定的同位素,与
为互为同分异构体
C.
与
的质量数不同,核外电子排布方式也不同
D.铯为IA元素,常温时,0.1mol·
的
溶液,pH<13
难度: 简单查看答案及解析
-
①②③④四种金属片两两相连浸入稀硫酸中都可组成原电池, ①②相连时,外电路电流从②流向①;①③相连时,③为正极;②④相连时,②上有气泡逸出;③④相连时,③的质量减少。据此判断这四种金属活动性由强到弱的顺序是( )
A.①③④② B.①③②④ C.③④②① D.③①②④
难度: 简单查看答案及解析
-
物质发生化学变化时,反应前后肯定不变的是( )
①电子总数②原子总数③质子总数④物质的总质量⑤物质的总能量⑥物质的种类
A.①②③④⑤ B.①②③④ C.②⑤⑥ D.③④⑤⑥
难度: 简单查看答案及解析
-
下列各组元素性质递变错误的是( )
A.
、Be、B原子最外层电子数逐渐增多 B.
、Na、K的金属性依次增强
C.P、S、Cl最高正价依次升高 D.N、O、F氢化物的稳定性依次减弱
难度: 简单查看答案及解析
-
进行化学实验,观察实验现象,通过分析推理得出正确的结论是化学学习的方法之一。对下列实验操作和事实的解释正确的是( )
A.某学生用pH试纸测新制氯水的pH值,先变红后褪色,是因为
有强氧化性
B.加热碳酸氢钠固体,质量变轻,说明碳酸氢钠不稳定
C.配制一定物质的量浓度溶液时发现浓度偏低,可能由于配制溶液所用的容量瓶事先末干燥
D.将铜片放入浓硫酸中,无明显实验现象,说明铜在冷的浓硫酸中发生钝化
难度: 简单查看答案及解析
-
实验室中以下物质的贮存方法,不正确的是( )
A.保存硫酸亚铁溶液时,要向其中加人少量硫酸和铁粉
B.少量金属钠保存在煤油中
C.少量液溴可用水封存,防止溴挥发
D.浓硝酸用带橡胶塞的细口、棕色试剂瓶盛放,并贮存在阴凉处
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.IA族元素的金属性一定比IIA族元素的金属性强
B.ⅥA族中氢化物最稳定的元素,其最高价含氧酸的酸性也最强
C.某一元素可能既显金属性,又显非金属性
D.短周期中,同周期元素所形成的简单离子的半径,从左到右逐渐减小
难度: 简单查看答案及解析
-
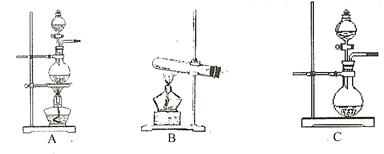
关于下列各实验装置的叙述中,不正确的是( )

A.装置①可用于分离
和
的混合物
B.装置②可用于收集
等气体
C.装置③中X若为
,可用于吸收
或HCl,并防止倒吸
D.装置④可用于干燥、收集
,并吸收多余的
难度: 简单查看答案及解析
-
若
代表阿伏加德罗常数的值,下列说法中正确的是( )
A.常温常压下,2mol
,与足量
完全反应,转移的电子总数为2NA
B.常温常压下,34g氨气中含有lO
个电子
C.常温常压下,22.4L氦气含有的原子数为
D.标准状况下,11.2LNO和11.2
,混合后气体分子数为
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是( )
A.用氯化铁溶液腐蚀电路板:
B.实验室吸收氯气:
C.
溶液与过量的NaOH溶液反应:
D.铜片溶于稀硝酸中:
难度: 简单查看答案及解析
-
在碱性条件下能够大量共存,而在强酸条件下却能发生氧化还原反应的离子组是( )
A. Ba2+、[Al(OH)]-、NO3-、Cl- B.K+、Na+、ClO-、Fe2+
C. Na+、I-、NO3-、SO42- D.NH4+、Na+、S2-、CO32-
难度: 简单查看答案及解析
-
下列实验过程中产生的现象与对应的图形正确的是( )

难度: 简单查看答案及解析
-
将氯气通入一定温度的
溶液中,得到含有次氯酸钾、氯酸钾和氯化钾的混合溶液。若反应过程中转移
个电子,所得溶液中
则参与反应的
的物质的量为( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
设
为阿伏加德罗常数的值,下列叙述正确的是( )
A.常温下,
·
B.标准状况下,
氟化氢中含有氟原子的数目为
C.常温常压下,46g的
D.
难度: 简单查看答案及解析
-
根据表中信息判断,下列选项不正确的是 ( )

A.第①组反应的其余产物为
B.第②组反应中
C.第③组反应中生成
D.氧化性由强到弱的顺序为
难度: 简单查看答案及解析