-
化学与生产、生活及社会发展密切相关,下列有关说法不正确的是
A. “血液透析”和“静电除尘”利用了胶体的不同性质
B. 把石灰浆喷涂在树干上可消灭树皮上的过冬虫卵
C. 用高锰酸钾溶液、酒精、双氧水的强氧化性进行杀菌消毒
D. 在食品袋中放入盛有硅胶和铁粉的透气小袋,可防止食物受潮、氧化
难度: 中等查看答案及解析
-
以下是从中国古代著作中摘取出来相关涉及化学叙述的解说,其中错误的是
A. “高奴县有洧水可燃”,这里的“洧水”指的是石油
B. “曾青涂铁,铁赤如铜”,其“曾青”是可溶性铜盐
C. “以火烧之,紫青烟起,乃真硝石也”是应用了焰色反应区分硝石与朴硝(Na2SO4)
D. “冬月灶中所烧薪柴之灰,令人以灰淋汁,取碱浣衣”中的碱是Na2CO3
难度: 简单查看答案及解析
-
已知
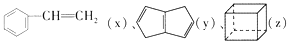 互为同分异构体,下列说法不正确的是
互为同分异构体,下列说法不正确的是A. z的二氯代物有三种
B. x、y的一氯代物均只有三种
C. x、y、z中只有x的所有原子可能处于同一平面
D. x、y 可使溴的四氯化碳溶液因发生加成反应而褪色
难度: 困难查看答案及解析
-
草酸晶体(H2C2O4·2H2O)无色,熔点为101℃,易溶于水,受热脱水、升华,170℃以上分解。某学生拟用下图装置做草酸晶体的分解实验并验证部分产物,下列说法错误的是
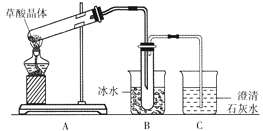
A. 装置A中的大试管口应略向下倾斜,是因为加热草酸晶体时会产生水
B. 装置B的主要作用是冷凝(水蒸气、草酸)等,防止草酸进入装置C中,干扰CO2的检验
C. 装置C中可观察到的现象是有气泡冒出,澄清石灰水变浑浊
D. 本实验能证明草酸晶体的分解产物有二氧化碳
难度: 中等查看答案及解析
-
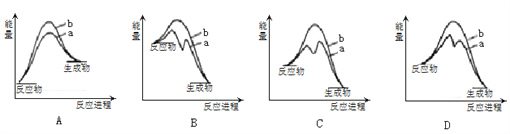
最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
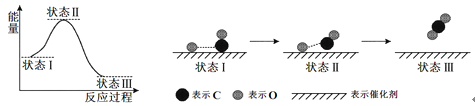
下列说法正确的是
A. 在该过程中,CO断键形成C和O B. 状态Ⅰ→状态Ⅲ表示CO与O2反应过程
C. CO和O生成CO2是吸热反应 D. CO和O生成了具有极性共价键的CO2
难度: 中等查看答案及解析
-
下列有关离子方程式或离子共存的叙述正确的是
A. 将磁性氧化铁溶于氢碘酸: Fe3O4+ 8H+= 2Fe3++ Fe2+ + 4H2O
B. 用肥皂(主要成份C17H35COONa)检验含有较多钙离子的硬水:2C17H35COO-+Ca2+=(C17H35COO)2Ca↓
C. 常温下,在
=0.1的溶液中:Na+、K+、AlO2-、HCO3-能大量共存
D. 在NaClO溶液中:SO32-、OH-、Cl-、K+
难度: 中等查看答案及解析
-
25℃时,将浓度均为0.1mol·L-1,体积分别为Va和Vb的HA溶液与BOH溶液按不同体积比混合,保持Va+Vb=100mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是

A. Ka(HA)=1×10-6
B. b点时,c(B+)=c(A-)
C. c点时,
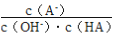 随温度升高而增大
随温度升高而增大D. a→c过程中水的电离程度始终增大
难度: 困难查看答案及解析
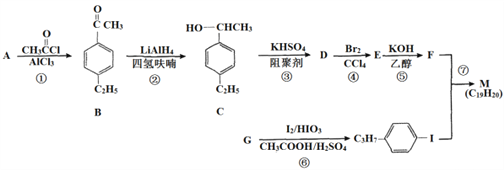
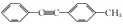 的合成路线_________。
的合成路线_________。