-
聚氯化铝铁(PAFC),通式是[Al2(OH)nCl(6-n)]m.[Fe2(OH)nCl(6-n)],是我国目前无机高分子最佳水处理剂,处理各种浓度的水效果相当好,且用量少.下列有关聚氯化铝铁的说法中正确的是( )
A.通式中:n值一定小于或等于5
B.处理水时只用聚氯化铝铁一种净水剂即可,不需再加入其他净水剂
C.聚氯化铝铁净水时与水中的杂质发生了化学反应
D.聚氯化铝铁中铁和铝的化合价不同难度: 中等查看答案及解析
-
下列关于有机物的说法不正确的是( )
A.有机物中一定含有碳元素
B.食用白糖和冰糖的成分都是蔗糖
C.乙酸和乙醇生成酯和水的反应属于取代反应
D.含有5个碳原子的饱和二元羧酸有3种难度: 中等查看答案及解析
-
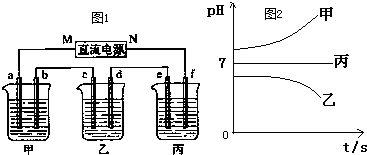
现有用离子交换膜(只允许对应的离子通过)和石墨作电极的电解槽电解饱和的Na2SO4溶液生产NaOH和H2SO4,下列说法中正确的是( )
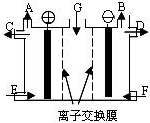
A.气体A是H2,溶液E是稀硫酸
B.气体B是H2,溶液D是NaOH溶液
C.Na2SO4溶液由G口加入,F口通入稀硫酸
D.靠阳极室一侧的是阳离子交换膜,阴极室导出的是氢气难度: 中等查看答案及解析
-
t℃时,在两个相同的密闭容器(等容)中分别进行SO2和SO3相互转化的实验,反应的化学方程式为2SO2(g)+O2(g)⇌2SO3(g),实验Ⅰ和实验Ⅱ情况分别为图Ⅰ和图Ⅱ所示:

数据分析发现:达到平衡时,化学状态Ⅰ和化学状态Ⅱ完全相同.下列叙述不正确的是( )
A.若实验ⅠSO2的起始浓度为1mol/L,则实验ⅠO2的起始浓度为0.5mol/L;实验ⅡSO3的起始浓度为1mol/L
B.若实验ⅠSO2的转化率为a%,则实验ⅡSO3 的转化率为1-a%
C.a、b两点时两容器内的速率相等
D.维持实验Ⅰ的起始浓度和实验温度不变,若密闭可变体积容器(等压容器)进行实验,达到化学平衡时:SO2的含量Ⅰ>Ⅱ难度: 中等查看答案及解析
-
叠氮酸(HN3)与醋酸酸性相似,下列叙述中错误的是( )
A.HN3水溶液中微粒浓度大小顺序为:c(HN3)>c(H+)>c(N3¯)>c(OH¯)
B.NaN3水溶液中离子浓度大小顺序为:c(Na+)>c(N3¯)>c(OH¯)>c(H+)
C.HN3与NH3作用生成的产物是共价化合物
D.与CO2含相等电子数
难度: 中等查看答案及解析
-
下列表示变化的用语中正确的一项是( )
A.NaHCO3的水【解析】
HCO3-+H2O=H3O++CO32-
B.1 L 0.5mol•L-1稀硫酸与1L 1mol•L-1氢氧化钠溶液反应放出57.3kJ 热量:H2SO4(aq)+2NaOH(aq)=Na2SO 4(aq)+2H2O(l)△H=-57.3kJ•mol -1
C.氢氧燃料电池的负极反应式为:O2+2H2O+2e一=4OH-
D.以惰性电极电解KCl溶液:2Cl一十2H2OH2↑+Cl2↑+2OH-
难度: 中等查看答案及解析
-
有①氨水 ②NH4Cl溶液 ③Na2CO3溶液 ④NaHCO3溶液各25mL,物质的量浓度均为0.1mol/L,下列说法正确的是( )
A.4种溶液pH的大小顺序:①>④>③>②
B.溶液①、②等体积混合后pH>7,则c(NH4+)<c
C.向溶液①、②中分别加入25 mL 0.1mol/L 盐酸后,溶液中c(NH4+):①>②
D.向溶液③、④中分别加入12.5 mL 0.1mol/L NaOH溶液后,两溶液中的离子种类相同难度: 中等查看答案及解析