-
下列各组粒子中属于同位素的是( )
A. 16O和18O B. H2O和D2O C. H2和D2 D. 24Mg和24Na
难度: 简单查看答案及解析
-
-NMR(核磁共振)可用于含碳化合物的结构分析,
表示的是( )
A. 核外有13个电子,其中6个能参与成键
B. 核内有6个质子,核外有7个电子
C. 质量数是13,原子序数是6,核内有7个质子
D. 质量数是13,原子序数是6,核内有7个中子
难度: 简单查看答案及解析
-
下列关于金属键、离子键的叙述中不正确的是( )
A. 金属键与离子键类似,也是一种电性作用,其没有方向性和饱和性
B. 在化学键中,有阳离子必有阴离子
C. 金属的导电性、延展性、导热性均与金属键有关
D. 构成金属键的自由电子在整个金属内部的三维空间中做自由运动
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A. 一般而言,n越大,电子离核平均距离越远,能量越低
B. 确定的n值,l有2n+1个值
C. 确定的l值,原子轨道数为2l个
D. ms描述电子自旋状态,电子的自旋状态与n、l无关
难度: 中等查看答案及解析
-
X和Y是原子序数大于4的短周期元素,Xm+和Yn-两种离子的核外排布相同,下列说法中正确的是( )
A. X的原子半径比Y小 B. X和Y的核电荷数之差为m-n
C. 电负性X>Y D. 第一电离能X<Y
难度: 中等查看答案及解析
-
下列事实不能用键能的大小来解释的是( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
难度: 中等查看答案及解析
-
下列轨道表示式所示的氧原子的核外电子排布中,氧原子处于基态的是( )
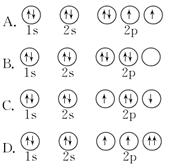
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列各组中的X和Y两种原子,在周期表中一定位于同一族的是( )
A. X原子和Y原子最外层都只有一个电子
B. X原子的核外电子排布为1s2,Y原子的核外电子排布为1s22s2
C. X原子2p能级上有三个电子,Y原子的3p能级上有三个电子
D. X原子核外M层上仅有两个电子,Y原子核外N层上也仅有两个电子
难度: 中等查看答案及解析
-
下列分子中存在的共价键类型与数目完全相同的是( )
A. CH4与NH3 B. C3H8与C2H4 C. Cl2与O2 D. H2与F2
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 所有共价键都有方向性
B. s轨道和p轨道重叠可以形成π键
C. 若把H2S分子写成H3S分子,违背了共价键的饱和性
D. 两个原子之间形成共价键时,可形成多个σ键
难度: 中等查看答案及解析
-
NF3分子中的中心原子采取sp3杂化,下列有关叙述正确的是( )
A. NF3分子的空间构型为三角锥形
B. NF3分子的空间构型为平面三角形
C. NF3分子的N—F键夹角与CH4分子中的C—H键的夹角相等
D. NF3分子是非极性分子
难度: 中等查看答案及解析
-
下列物质中属于含有极性键的非极性分子的是( )
A. CS2 B. H2O C. CH3CH2Cl D. NH3
难度: 简单查看答案及解析
-
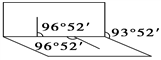
短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是( )
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 离子Y2-和Z3+的核外电子数和电子层数都不相同
D. 元素X与元素Z的最高正化合价之和的数值等于8
难度: 中等查看答案及解析
-
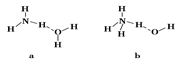
下列说法正确的是( )
A.HF、HCl、HBr、HI的熔、沸点依次升高
B.H2O的熔、沸点大
于H2S是由
于H2O分子之间存在氢键
C.乙醇分子与水分子之间只存在范德华力
D.氯的各种含氧酸的酸性由强到弱排列为HClO>HClO2>HClO3>HClO4
难度: 中等查看答案及解析
-
元素A的各级电离能数据如下:则元素A的常见价态是( )
I1
I2
I3
I4
I5
I6
I/kJ·mol-1
578
1817
2745
11578
14831
18378
A. +1 B. +2 C. +3 D .+6
难度: 简单查看答案及解析
-
下列化合物中含有手性碳原子的是( )
A.CCl2F2 B.CH3—CHCl—COOH
C.CH3CH2OH D.CH2Cl—OH难度: 中等查看答案及解析