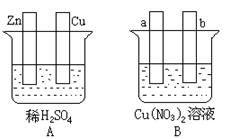
-
为了除去MgCl2溶液中的FeCl3,可在加热搅拌的条件下加入的一种试剂是
A.NaOH B.MgO C.氨水 D.铁粉
难度: 简单查看答案及解析
-
某同学为了使反应2HCl + 2Ag2AgCl + H2↑能进行,设计了下列四个实验,如下图所示,你认为可行的方案是
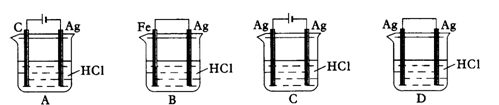
难度: 简单查看答案及解析
-
用两支惰性电极插入100毫升硝酸银溶液中,通电电解。当电解液 pH值从6.0变为3.0时(设电解时阴极上没有氢气析出,且电解液在电解前后体积变化可以忽略),电极上应析出银的质量是
A.27mg B.10.8mg C.54mg D.108mg
难度: 简单查看答案及解析
-
为了降低某水库的铁闸门被腐蚀的速率,可以采取如右图所示的方案,其中焊接在铁闸门上的固体材料R可以采用
A.铜 B.钠 C.锌 D.石墨
难度: 简单查看答案及解析
-
在原电池和电解池的电极上所发生的反应,属于氧化反应的是

A.原电池的正极和电解池的阳极所发生的反应
B.原电池的正极和电解池的阴极所发生的反应
C.原电池的负极和电解池的阳极所发生的反应
D.原电池的负极和电解池的阴极所发生的反应
难度: 简单查看答案及解析
-
用标准盐酸滴定未知浓度的氨水时,对指示剂的最佳选择是
A.酚酞 B.甲基橙 C.石蕊 D.前三者均可
难度: 简单查看答案及解析
-
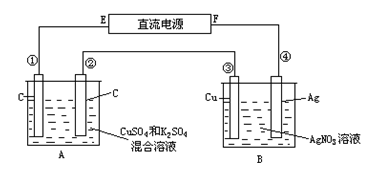
用惰性电极电解Fe2(SO4)3和CuSO4的混合溶液,下列说法正确的是
A.阴极反应式为:Cu2++2e—====Cu,当有Cu2+存在时,Fe3+不放电
B.阴极上首先析出铁,然后析出铜
C.阴极先是Fe3+放电,后Cu2+放电
D.阴极上不可能析出铜
难度: 简单查看答案及解析
-
用0.01 mol/LNaOH溶液完全中和pH = 3 的下列溶液各100 mL。需NaOH溶液体积最大的是
A.盐酸 B.硫酸 C.硝酸 D.醋酸
难度: 简单查看答案及解析
-
用铂电极分别电解KCl溶液和K2SO4溶液时,都会出现的现象或实验结果是
A.溶液中K+离子浓度都不变
B.溶液的pH都不变
C.阳极上都生成能使湿润的碘化钾淀粉试纸变成蓝色的气体
D.阴极上都生成可燃的气体
难度: 简单查看答案及解析
-
将分别盛有熔融的氯化钾、氯化镁、氧化铝的三个电解槽串联,在一定条件下通电一段时间后,析出钾、镁、铝的物质的量之比为
A.1:2:3 B.3:2:1 C.6:3:2 D.3:3:1
难度: 简单查看答案及解析
-
将氨水缓缓地滴入盐酸中至中性,下列有关的说法:①盐酸过量 ②氨水过量 ③恰好完全反应 ④c (NH4+) = c(Cl-) ⑤c (NH4+) < c(Cl-) 正确的是
A.①⑤ B.③④ C.②⑤ D.②④
难度: 简单查看答案及解析
-
下列表示水解的离子方程式正确的是:
A.CH3COO— + H2O
CH3COOH + OH— B.NH4+ + H2O
NH4OH + H+
C.S2- + 2H2O
H2S+2OH- D.HCO3- + H2O
H3O++CO32-
难度: 简单查看答案及解析
-
三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO—,把二价镍氧化为三价镍。以下说法正确的是
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式是:2Cl—-2e—=====Cl2
D.产生能使1mol二价镍转化为三价镍所需的Cl2,外电路中通过了1mol电子
难度: 简单查看答案及解析
-
家用炒菜铁锅用水清洗放置后,出现红棕色的锈斑,在此变化过程中不发生的化学反应是
A.
B.
C.
D.
难度: 简单查看答案及解析
-
某原电池的电池反应为:Fe+2Fe3+===3Fe2+,与此电池反应不符的原电池是
A.铜片、铁片、FeCl3溶液组成的原电池
B.石墨、铁片、Fe(NO3)3溶液组成的原电池
C.铁片、锌片、Fe2(SO4)3溶液组成的原电池
D.银片、铁片、Fe(NO3)2溶液组成的原电池
难度: 简单查看答案及解析
-
一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷和氧气,电极反应
为:
;
有关此电池的推断错误的是
A.通乙烷的电极为负极
B.参加反应的
与
的物质的量之比为7:2
C.放电一段时间后,KOH的物质的量浓度将下降
D.在电解质溶液中
向正极移动
难度: 简单查看答案及解析
-
根据下列事实,判断离子的氧化性顺序为①A+B2+ A2++B ②D+2H2O D(OH)2+H2↑
③以B、E为电极与E的盐溶液组成原电池,电极反应为:E2++2e-=E,B-2e-=B2+
A.D2+>A2+>B2+>E2+ B.D2+>E2+>A2+>B2+ C.E2+>B2+>A2+>D2+ D.A2+>B2+>D2+>E2+
难度: 简单查看答案及解析
-
在给定的四种溶液中,加入以下各种离子,各离子可能在原溶液中大量共存的是
A.滴加石蕊试液显红色的溶液 Fe3+、NH4+、Cl-、S2-
B.pH=1的溶液 Cu2+、Na+、Mg2+、NO3-
C.水电离出来的c(H+)=10-13mol/L的溶液 K+、HCO3-、Br-、Ba2+
D.Na2SO4溶液 K+、Ba2+、NO3-、Cl-
难度: 简单查看答案及解析
-
属于离子化合物的电解质(如NaCl)发生电离的条件是
A.水溶液中 B.熔融状态 C.通直流电 D.通交流电
难度: 简单查看答案及解析
-
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为
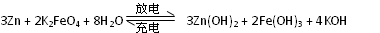
下列叙述不正确的是
A.放电时每转移3 mol电子,正极有1mol K2FeO4被氧化
B.充电时阳极反应为:Fe(OH)3 —3e— + 5 OH— = FeO
+ 4H2O
C.放电时负极反应为:Zn—2e— +2OH—= Zn(OH)2
D.放电时正极附近溶液的碱性增强
难度: 简单查看答案及解析
 回答下列问题:
回答下列问题: