-
下列有关仪器的使用方法或实验操作正确的是
A. 洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B. 用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体
C. 测定新制氯水的pH,用玻璃棒取液体滴在pH试纸上,再对照标准比色卡读数
D. 酸碱中和滴定时,滴定管使用前需用待装液润洗而锥形瓶不用
难度: 简单查看答案及解析
-
下列有关物质分类的说法正确的是
A. 二氧化碳、二氧化硅、一氧化碳均为酸性氧化物
B. 雾、稀豆浆、氯化铁溶液均为胶体
C. 烧碱、冰醋酸、稀硫酸均属于电解质
D. 分子中含有两个氢原子的酸不一定是二元酸
难度: 困难查看答案及解析
-
设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 1mol NaHSO4熔融或溶于水时电离出的离子总数均为3NA
B. 17g H2O2含有0.5NA个非极性共价键
C. 1L 0.1mol/L 稀硝酸与足量金属铝反应,生成NO2的分子个数为0.5NA
D. 标准状况下,22.4L Cl2溶于水转移的电子数为NA
难度: 中等查看答案及解析
-
下列实验操作正确且能达到相应实验目的的是
实验目的
实验操作
A
称取2.0gNaOH固体
先在托盘上各放一张滤纸,然后在右盘上添加2g砝码,左盘上添加NaOH固体
B
配制FeCl3溶液
将FeCl3固体溶解于适量蒸馏水
C
检验溶液中是否含有NH4+
取少量试液于试管中,加入NaOH溶液并加热,用湿润的红色石蕊试纸检验产生的气体
D
验证铁的吸氧腐蚀
将铁钉放入试管中,用盐酸浸没
A. A B. B C. C D. D
难度: 简单查看答案及解析
-
对于某些离子的检验及结论一定正确的是
A. 向某溶液中加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,则原溶液中一定有CO32
B. 向某溶液中加入氯化钡溶液有白色沉淀产生,再加稀硝酸,沉淀不消失,则原溶液中一定有Ag+
C. 向某溶液中先加入盐酸酸化,没有明显现象,再加入BaCl2溶液,有白色沉淀产生,则原溶液中一定有SO42-
D. 向某溶液中加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,则原溶液一定有Ba2+
难度: 中等查看答案及解析
-
下列所列物质,贴错了危险警告标签的是
选项
A
B
C
D
物质
浓硫酸
酒精
汽油
氯酸钾
标签
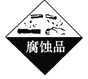



A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A. 向1mol FeBr2 的溶液中通入1molCl2:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
B. 向AlCl3溶液中加入过量氨水: Al3++4OH-=AlO2-+2H2O
C. 向Ba(OH)2溶液中滴加NaHSO4溶液至中性:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 向澄清石灰水中加入过量的Ca(HCO3)2溶液:Ca2++OH-+HCO3- = CaCO3↓+H2O
难度: 中等查看答案及解析
-
今有一混合物的水溶液,只可能含有以下离子中的若干种:K+,NH4+,Cl-,Mg2+,Ba2+,CO32-,SO42-,现取三份100mL该溶液进行如下实验:
(1)第一份加入AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤干燥后,沉淀质量为2.33g.
根据上述实验,以下推测正确的是( )
①K+一定存在 ②100mL溶液中含0.01mol CO32-
③Cl-可能存在 ④Ba2+一定不存在,Mg2+可能存在.
A. ①②③ B. ①③ C. ①②④ D. ②③
难度: 困难查看答案及解析
-
现取m克铝镁合金与一定浓度的稀硝酸恰好完全溶解(假定硝酸的还原产物只有NO),向反应后的混合溶液中滴加bmol/LNaOH溶液,当滴加到VmL时,得到沉淀质量恰好为最大值n 克,则下列有关该实验的说法中正确的有:
①沉淀中氢氧根的质量为(n-m)克
②恰好溶解后溶液中的NO3-离子的物质的量为
mol
③反应过程中转移的电子数为
mol
④生成NO气体的体积为
L
⑤与合金反应反应的硝酸的物质的量为
mol
A. 2项 B. 3项 C. 4项 D. 5项
难度: 中等查看答案及解析
-
下列实验现象预测正确的是
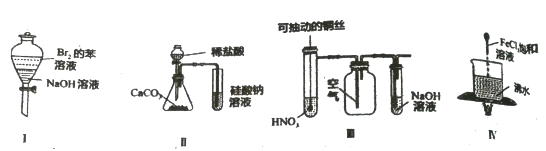
A. 实验I:振荡后静置,上层溶液颜色保持不变
B. 实验II:试管溶液中中出现气泡,溶液先出现浑浊后变澄清
C. 实验III:微热稀HNO3片刻,溶液中有气泡产生,广口瓶内始终保持无色
D. 实验IV:加热至混合液呈红褐色,停止加热,该分散系产生丁达尔效应
难度: 困难查看答案及解析
-
饮茶是中国人的传统饮食文化之一。为方便饮用,可通过以下方法制取罐装饮料茶:
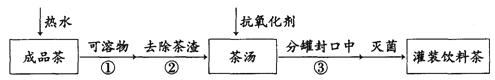
关于上述过程涉及的实验方法、实验操作和物质作用中说法错误的是
A. 维生素C可作抗氧化剂 B. ①是萃取 C. ③是分液 D. ②是过滤
难度: 困难查看答案及解析
-
同一还原剂与多种氧化剂在一起时,先与氧化性强的粒子反应,待强的反应完后,再与氧化性弱的反应,称为反应先后规律.已知氧化性:Fe3+>Cu2+,在溶有Fe2(SO4)3和CuSO4的溶液中加入铁粉,下列说法中不正确的是
A. 若铁粉有剩余,则不溶物中一定有铜
B. 若铁粉有剩余,则溶液中的金属阳离子只有Fe2+
C. 若铁粉无剩余,且溶液中有Cu2+,则溶液中一定无Fe3+
D. 若铁粉无剩余,且溶液中无Cu2+,则溶液中一定有Fe2+,一定无Fe3+
难度: 中等查看答案及解析
-
某磁黄铁矿的主要成分是FexS(S为-2价),既含有Fe2+又含有Fe3+。将一定量的该磁黄铁矿与100mL的盐酸恰好完全反应(注:矿石中其他成分不与盐酸反应),生成硫单质2.4g,FeCl2 0.425mol和一定量H2S气体,且溶液中无Fe3+。则下列说法正确的是
A. 100mL的盐酸中HCl物质的量浓度为7.5mol/L
B. 生成的H2S气体在标准状况下的体积为2.24L
C. 该磁黄铁矿FexS中,Fe2+与Fe3+的物质的量之比为3:1
D. 该磁黄铁矿中FexS的x=0.85
难度: 极难查看答案及解析
-
将一定量的Cl2通入体积为40mL、浓度为7.5mol/L的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),测得反应后溶液中有三种含氯元素的离子,其中ClO-物质的量为0.06mol和ClO物质的量0.03mol,下列说法不正确的是
A. 该反应的离子方程式为:5Cl2+10OH-=7Cl-+2ClO-+ClO3—+5H2O
B. 该反应中,氧化剂与还原剂物质的量之比为5:3
C. 上述苛性钾溶液中含有0.3mol的KOH
D. 反应后生成的ClO-和ClO3-两种离子在一定条件下均有氧化性
难度: 极难查看答案及解析
-
在复杂的体系中,确认化学反应先后顺序有利于解决问题,下列化学反应先后顺序判断正确的是
A. 在含等物质的量的AlO2-、OH-、CO32-的溶液中,逐滴加入盐酸:AlO2-、OH-、CO32-
B. 在含等物质的量的FeBr2、Fel2的溶液中,缓慢通入氯气:I-、Br-、Fe2+
C. 在含等物质的量的Fe3+、Cu2+、H+的溶液中加入锌粉:Fe3+、Cu2+、H+、Fe2+
D. 在含等物质的量的Ba(OH)2、KOH的溶液中,缓慢通入CO2:KOH、Ba(OH)2、K2CO3、BaCO3
难度: 极难查看答案及解析

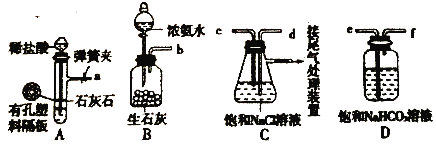
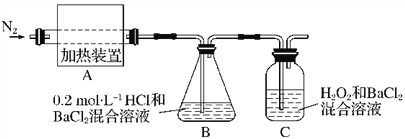
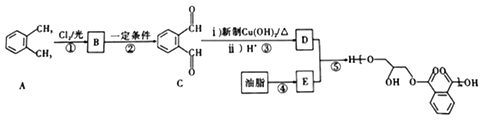
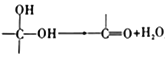 。回答下列问題:
。回答下列问題: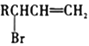 ,以2-溴丙烷为原料(其他试剂任选),设计制备E的合成路线:____________________________________________________。
,以2-溴丙烷为原料(其他试剂任选),设计制备E的合成路线:____________________________________________________。