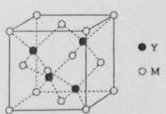
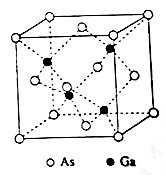
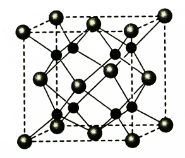
-
下列说法正确的是
A.分子中一定存在化学键
B.分子中若有化学键,则一定存在σ键
C.p和p轨道不能形成σ键
D.含π键的物质不如含σ键的物质稳定
难度: 简单查看答案及解析
-
下列叙述中正确的是
A.NH3、CO、CO2 都是极性分子
B.CH4、CCl4 都是含有极性键的非极性分子
C.HF、HCl、HBr、HI的稳定性依次增强
D.CS2、H2O、C2H2 都是直线型分子
难度: 简单查看答案及解析
-
四种短周期主族元素W、X、Y、Z的原子序数依次增大,W、X的简单离子具有相同电子层结构,X的原子半径是短周期主族元素原子中最大的,W与Y同族,Z与X形成的离子化合物的水溶液呈中性。下列说法正确的是
A. 简单离子半径:W<X<Z
B. W与X形成的化合物溶于水后溶液呈碱性
C. 气态氢化物的热稳定性:W<Y
D. 最高价氧化物的水化物的酸性:Y>Z
难度: 困难查看答案及解析
-
下列各组表述中,两个原子不属于同种元素原子的是
A.3p能级有一个空轨道的基态原子和核外电子的排布式为1s22s22p63s23p2的原子
B.2p能级无空轨道,且有一个未成对电子的基态原子和原子的最外层电子排布式为2s22p5的原子
C.M层全充满而N层为4s2的原子和核外电子排布式为1s22s22p63s23p64s2的原子
D.最外层电子数是核外电子总数1/5的原子和最外层电子排布式为4s24p5的原子
难度: 中等查看答案及解析
-
离子化合物①NaCl、②CaO、③NaF、④MgO中,晶格能从小到大顺序正确的是( )
A.①②③④ B.①③②④ C.③①④② D.④②①③
难度: 简单查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增大,W、X原子的最外层电子数之比为4∶3,Z原子比X原子的核外电子数多4。下列说法正确的是
A. W、Y、Z的电负性大小顺序一定是Z>Y>W
B. W、X、Y、Z的原子半径大小顺序可能是W>X>Y>Z
C. Y、Z形成的分子的空间构型可能是正四面体
D. WY2分子中σ键与π键的数目之比是2∶1
难度: 困难查看答案及解析
-
下列说法或有关化学用语的表达不正确的是
A. 在基态多电子原子中,p轨道电子能量不一定高于s轨道电子能量
B. 核外电子排布由1s22s22p63s1→1s22s22p6 的变化需要吸收能量
C. 某元素基态原子的电子排布图

D. Ca2+离子基态电子排布式为1s22s22p63s23p6
难度: 中等查看答案及解析
-
对充有氖气的霓红灯管通电,灯管发出红色光。产生这一现象的主要原因( )
A. 电子由激发态向基态跃迁时以光的形式释放能量
B. 电子由基态向激发态跃迁时吸收除红光以外的光线
C. 氖原子获得电子后转变成发出红光的物质
D. 在电流作用下,氖原子与构成灯管的物质反应
难度: 中等查看答案及解析
-
下列对一些实验事实的解释正确的是
选项
实验事实
解释
A
水加热到较高温度都难以分解
水分子间存在氢键
B
白磷为正四面体分子
白磷分子中P-P键间的键角是109°28′
C
用苯萃取碘水中的I2
苯和I2均为非极性分子,且苯与水互不相溶
D
H2O的沸点高于H2S
H-O键的键长比H-S键的键长短
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
下列分子或离子中,VSEPR模型名称与分子或离子的立体构型名称不一致的是( )
A.CO2 B.H2O C.CO32﹣ D.CCl4
难度: 简单查看答案及解析
-
化学学习中常用类推方法,下列类推正确的是
A. CO2为直线形分子,SO2也为直线形分子
B. 固态CS2是分子晶体,固态SiO2也是分子晶体
C. NCl3中N原子是sp3杂化,BCl3中B原子也是sp3杂化
D. Al(OH)3能溶于NaOH溶液,Be(OH)2也能溶于NaOH溶液
难度: 困难查看答案及解析
-
下列说法正确的是
A. HI沸点比HBr的沸点低
B. 用X射线衍射实验的方法,可以区分晶体和非晶体
C. CH3CH2CH2CH3分子中有两个手性碳原子
D. 由于HF分子间存在氢键,故HF比HCl稳定
难度: 中等查看答案及解析
-
现有四种晶体,其离子排列方式如图所示,其中化学式正确的是
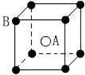
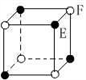
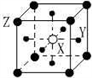

A. AB2 B. EF2 C. XY3Z D. AB3
难度: 中等查看答案及解析
-
下列物质的变化规律,与共价键的键能有关的是
A. F2、Cl2、Br2、I2的熔、沸点逐渐升高
B. HF的熔、沸点高于HCl
C. 金刚石的硬度、熔点、沸点都高于晶体硅
D. NaF、NaCl、NaBr、NaI的熔点依次降低
难度: 中等查看答案及解析
-
下列有关元素周期表和元素周期律的说法,错误的是
①元素周期表中s区、d区和ds区的元素都是金属元素
②d区元素最后一个核外电子一定填充在s能级上
③原子核外电子的能层越多,原子半径越大
④同一周期自左至右,元素的第一电离能依次增大
A. 只有①②③ B. 只有②③ C. 只有③④ D. ①②③④
难度: 简单查看答案及解析
-
下列有关说法正确的是
A. C、N、O三种元素第一电离能从大到小的顺序是O>N>C
B. 根据同周期元素的第一电离能变化趋势,推出Al的第一电离能比Mg大
C. 根据主族元素最高正化合价与族序数关系,推出卤族元素最高正价都是+7
D. Ni原子的核外电子排布式为1s22s22p63s23p63d84s2
难度: 中等查看答案及解析
-
下表列出了某短周期元素R的各级电离能数据(用I1、I2……表示,单位为kJ·mol-1)。下列关于元素R的判断中一定正确的是( )

①R的最高正价为+3价 ②R元素位于元素周期表中第ⅡA族 ③R元素第一电离能大于同周期相邻元素 ④R元素基态原子的电子排布式为1s22s2
A. ①② B. ②③ C. ③④ D. ①④
难度: 中等查看答案及解析
-
下列推论正确的是
A. NH
为正四面体结构,可推测PH
也为正四面体结构
B. SiH4的沸点高于CH4,可推测PH3的沸点高于NH3
C. CO2为非极性分子,可推测SO2也为非极性分子
D. C2H6是碳链为直线型的非极性分子,可推测C3H8也是碳链为直线型的非极性分子
难度: 中等查看答案及解析
-
氮氧化铝(AlON)属原子晶体,是一种超强透明材料,下列描述错误的是
A. AlON和石英的化学键类型相同 B. AlON和石英晶体类型相同
C. AlON和Al2O3的化学键类型不同 D. AlON和Al2O3晶体类型相同
难度: 中等查看答案及解析
-
下列各物质中,按熔点由高到低的顺序排列正确的是
A. CH4>SiH4>GeH4>SnH4 B. KCl>NaCl>MgCl2>MgO
C. Rb>B>Na>Li D. 金刚石>Si>钠
难度: 中等查看答案及解析
-
高温下,超氧化钾晶体呈立方体结构,晶体中氧的化合价部分为0价,部分为-2价。如图所示为超氧化钾晶体的一个晶胞,则下列说法正确的是
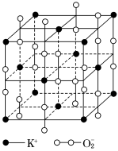
A.超氧化钾的化学式为KO2,每个晶胞含有4个K+和4个O2-
B.晶体中每个K+周围有8个O2-,每个O2-周围有8个K+
C.晶体中与每个K+距离最近的K+有8个
D.晶体中与每个K+距离最近的K+有6个
难度: 困难查看答案及解析