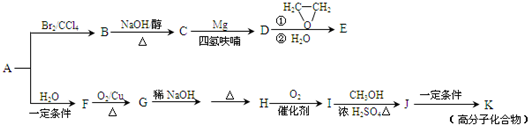
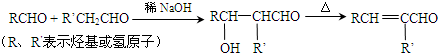
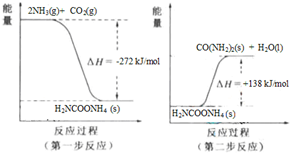
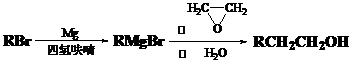-
下列做法不符合“绿色化学”思想的是( )
A.将工业废水直接排放到海洋中
B.生产中尽可能提高能源的利用率
C.生产中尽可能将反应物的原子全部转化为期望的最终产物
D.将开采出的煤通过干馏、气化、液化等多种途径实现其综合利用难度: 中等查看答案及解析
-
下列说法正确的是( )
A.可以用浓溴水区分苯和甲苯
B.淀粉和纤维素水解的最终产物均为果糖
C.实验室中,可以用电石和饱和食盐水制取乙炔NH2
D.H2N-CH2-COOH和缩合只能形成一种二肽
难度: 中等查看答案及解析
-
高炉炼铁的主要反应是:Fe2O3+3CO⇌2Fe+3CO2.下列说法正确的是( )
A.CO2的电子式为
B.Fe2O3分别与浓硝酸和稀硝酸反应,二者产物不同
C.在高炉炼铁过程中,若增加炼铁高炉的高度能提高CO的转化率
D.在高炉炼铁过程中,将铁矿石粉碎后投入高炉可以提高该反应的化学反应速率难度: 中等查看答案及解析
-
下列有关氧化还原反应的说法正确的是( )
A.浓盐酸在化学反应中既可以做氧化剂,又可以作还原剂
B.工业上常以SiO2为原料制取粗硅,这一过程中,硅元素被氧化
C.在任何条件下都不能发生反应:Cu+H2SO4=CuSO4+H2↑
D.亚氯酸可发生分解反应:HClO2→ClO2↑+Cl2+H2O(未配平),1 mol HClO2分解时,转移电子的物质的量为1 mol难度: 中等查看答案及解析
-
孔雀石的主要成分为xCuCO3•yCu(OH)2•zH2O,为测定其中CuCO3的质量分数,称取a g样品进行实验.下列实验方案可行的是( )
A.充分加热样品,用碱石灰吸收逸出气体,增重b g
B.加热至样品质量不再发生变化,称得其质量为b g
C.向样品中加入足量的稀盐酸,用排水法收集逸出气体,得b mL气体
D.向样品中加入足量的稀盐酸,充分反应,将生成的气体全部通入到足量Ba(OH)2溶液中,过滤、洗涤、烘干,得b g固体难度: 中等查看答案及解析
-
甲、乙、丙、丁、戊是中学常见的无机物,其中甲、乙均为单质,它们的转化关系如图所示(某些条件和部分产物已略去).下列说法不正确的是( )
A.若甲既能与盐酸反应又能与NaOH溶液反应,则丙可能属于两性氧化物
B.若甲为短周期中原子半径最大的主族元素的单质,且戊为碱,则丙只能为Na2O2
C.若丙、丁混合产生白烟,且丙为18电子分子,丁为10电子分子,则乙的水溶液可能具有漂白作用
D.若甲、丙、戊含有同一种元素,则三种物质中,该元素的化合价由低到高的顺序可能为:甲<丙<戊难度: 中等查看答案及解析
-
室温下,pH相差1的两种一元碱溶液A和B,分别加水稀释时,溶液的pH变化如图所示.下列说法正确的是( )
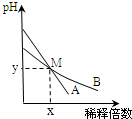
A.稀释前,c(A)=10 c(B)
B.稀释前,A溶液中由水电离出的OH-的浓度大于10-7 mol/L
C.在M点,A、B两种碱溶液中阳离子的物质的量浓度相等
D.用醋酸中和A溶液至恰好完全反应时,溶液的pH为7难度: 中等查看答案及解析