-
化学与生产、生活息息相关,下列说法错误的是( )
A. 古代利用明矾溶液的酸性来清除铜镜表面的铜锈
B. 古代湿法炼铜反应的方程式是:Fe+CuSO4=Cu+FeSO4
C. 侯氏制碱法工业过程中应用了物质在水中的溶解度的差异
D. 硫酸钡之所以可以用来做“钡餐”是因为Ba2+对人体无害
难度: 中等查看答案及解析
-
25℃时,在含有大量Ba2+的某澄清透明溶液中,由水电离产生的OH-物质的量浓度1×10-12mol/L,则在此溶液中还可能大量共存的离子组有( )
A. Na+、Fe2+、NO3- B. Cu2+、Mg2+、Cl-
C. NH4+、HCO3-、SCN- D. K+、CH3COO-、SO42-
难度: 中等查看答案及解析
-
W、X、Y、Z为短周期主族元素,原子序数依次增加, W的一种核素在考古时常用来鉴定一些文物的年代。化合物XZ是一种重要的调味品,Y原子的最外层电子数等于其电子层数,Z的单质常温下为气体。下列说法错误的是( )
A. 元素W能与氢形成多种原子个数比为1:1的化合物
B. 元素X能与氧形成原子个数比为1:1、2:1的化合物
C. 元素Y的最高价氧化物对应的水化物,既能跟W的最高价氧化物对应的水化物反应,也能跟X最高价氧化物对应的水化物反应
D. Y、Z形成的化合物熔融状态下不导电
难度: 中等查看答案及解析
-
下列有关化学实验的描述错误的是( )
A. 在蒸馏操作中,冷凝管应在反应加热前先通入冷水,停止加热后再关闭进冷水开关
B. 蒸馏不仅可以用来分离相溶性液体,还可以用来分离可溶性固体和液体形成的混合物
C. 过滤操作中洗涤沉淀时,当加蒸馏水淹没沉淀后,为了加速过滤,常用玻璃棒轻轻搅拌
D. 在萃取操作中,萃取剂必须满足三个条件:与原溶剂不相溶、不与溶质反应、溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度
难度: 中等查看答案及解析
-
下列物质性质与对应用途错误的是( )
A. Na2FeO4有强氧化性,还原产物又易水解成胶体,是自来水理想的消毒剂和净水剂
B. 晶体硅因熔点高硬度大,常用作芯片
C. 氮气的化学性质稳定,常用作粮食的保护气
D. AgBr有感光性,常用作胶片和太阳镜中的感光剂
难度: 中等查看答案及解析
-
将一定量的氯气通入30 mL浓度为10.00 mol/L的氢氧化钠浓溶液中,氢氧化钠完全反应后溶液中只有三种溶质:NaCl、NaClO、NaClO3。下列判断正确的是( )
A. 与NaOH反应的氯气一定为0.3 mol
B. n(Na+)∶n(Cl-) 可能为7∶3
C. 若反应中转移的电子为n mol,则0.15n 0.25
D. n(NaCl)∶n(NaClO)∶n(NaClO3)可能为11∶5∶1
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 在Na和Ca(HCO3)2溶液反应中:2Na+ Ca(HCO3)2=CaCO3↓+ Na2CO3+H2↑,氧化剂为Ca(HCO3)2
B. 烷烃和环烷烃都是饱和烃,苯及其同系物,都是不饱和烃
C. 在一定条件下,Al(OH)3、Fe(OH)3都不可以通过化合反应来制取
D. 一定质量的铝粉分别与足量的盐酸和氢氧化钠溶液反应,当生成等量的氢气时,消耗盐酸和氢氧化钠的物质的量之比一定为3∶1
难度: 中等查看答案及解析
-
固体NH5为离子化合物,它与水反应的化学方程式为:NH5+H2O=NH3·H2O+H2↑,它也能和乙醇反应生成氢气。下列有关NH5的叙述正确的是( )
A. 1mol NH5中含有5NA个N-H键 B. 在NH5中氮元素的化合价为-5
C. NH5与乙醇反应时发生了取代反应 D. NH5与水反应时NH5被氧化了
难度: 中等查看答案及解析
-
下列关于钠及其化合物的叙述正确的是( )
A. 不管是单质钠还是钠的化合物,其焰色反应的颜色都是黄色
B. 将足量的Na2O和Na2O2分别加入到酚酞溶液中充分反应后,观察到的现象相同
C. Na2O和Na2O2中阴阳离子的个数比,前者1:1后者1:2
D. 将Na2O2和NaHCO3固体混合加热到2000C,完全反应后,趁热放出的气体为混合气体,则Na2O2和NaHCO3两者的物质的量关系:Na2O2≥NaHCO3
难度: 困难查看答案及解析
-
向一定量的铜和三氧化二铁的混合物中加入200mL 1.5mol/L的稀硫酸,完全反应后固体无剩余,所得溶液中只有两种溶质,假设反应前后溶液体积不变,则下列说法错误的是( )
A. 原混合物中Cu和Fe2O3的物质的量之比为1:1
B. 反应后的溶液中Fe2(SO4)3的物质的量的浓度为0.5mol/L
C. 若用CO还原等质量的原混合物,充分反应后,质量将减少4.8克
D. 若用KMnO4溶液来滴定反应后的溶液,完全反应后,将消耗KMnO4 0.04mol
难度: 中等查看答案及解析
-
pH=0的某溶液中还可能存在Al3+、Fe2+、NH4+、Ba2+、Cl-、CO32-、SO42-、NO3-中的若干种,现取适量溶液进行如下一系列实验,下列有关判断正确的是( )
A. 向溶液中加入硝酸钡溶液时,有气体放出,说明原溶液中一定有Fe2+无NO3-
B. 向溶液中加入硝酸钡溶液时,有沉淀生成,一定有SO42-或CO32-
C. 向溶液中加入足量的NaOH溶液并加热,无沉淀有气体放出,则有NH4+ 没有Al3+
D. 向加入足量的NaOH溶液后的溶液中通入足量CO2气体,一定无明显现象
难度: 困难查看答案及解析
-
亚氨基锂(Li2NH)是一种储氢容量高、安全性好的固体储氢材料,其储氢原理可表示为:Li2NH + H2
LiNH2+LiH。下列有关说法正确的是( )
A. Li2NH中N的化合价是-1 B. 该反应中H2既是氧化剂又是还原剂
C. Li+和H-的离子半径相等 D. 此法储氢和钢瓶储氢的原理相同
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,下列说法正确的是( )
A. 24gNaH中阴离子所含电子总数为2NA
B. 标准状况下,44.8LNO与22.4LO2充分混合后,气体中分子总数为2NA
C. 在0.lmol/L的K2CO3溶液中,因CO32-的水解,阴离子数目大于0.1NA
D. 300mL 2mol/L乙醇溶液中所含分子数为0.6NA
难度: 中等查看答案及解析
-
下列说法中不正确的是( )
A. 在金属的冶炼方法中,铝热法,本质上属于热还原法
B. 化学上所说的钢铁,其实钢是钢,铁是铁,钢是混合物,而铁是纯净物
C. 对于反应:FeCuS2 + S
FeS2 + CuS,其中FeS2既是氧化产物又是还原产物
D. 已知BrCl的化学性质跟Cl2相似,则BrCl跟水反应(生成HCl和HBrO)也是氧化还原反应
难度: 中等查看答案及解析
-
下列反应不属于水解反应的是( )
A. CO32-+H2O
HCO3-+OH- B. Fe3++3HCO3-=Fe(OH)3↓ +3CO2↑
C. A1O2-+HCO3-+H2O=Al(OH)3↓+CO32- D. Al3++3A1O2-+6H2O=4Al(OH)3↓
难度: 简单查看答案及解析
-
已知羟基和Cl原子不能连在同一碳原子上,且羟基也不能连在双键碳原子上,则与钠反应能生成氢气的有机物C4H7ClO,其所有可能的同分异构体数目有( )
A. 9种 B. 12种 C. 15种 D. 20种
难度: 困难查看答案及解析



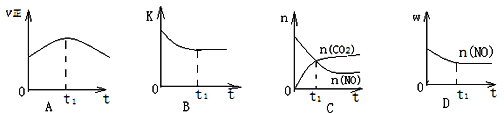
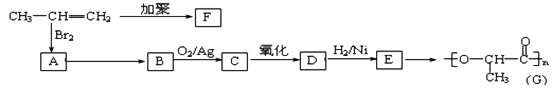


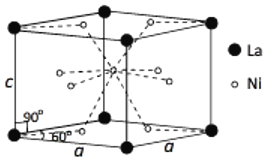
 。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。
。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为________。